Содержание
За что оштрафуют, а за что лишат прав при повороте и развороте — Kolesa.kz || Почитать
Выезд на сторону проезжей части дороги, предназначенную для встречного движения, в случаях, если это запрещено Правилами дорожного движения, в том числе сопряжённых с разворотом или поворотом, влечёт лишение права на управление транспортными средствами на срок один год.
Вот так грозно звучит освежённая часть 3 статьи 596 КоАП с 15 июля 2017 года. И вроде всё понятно: развернулся там, где нельзя, — остался без прав. Но как показало углублённое изучение этого вопроса, не всегда.
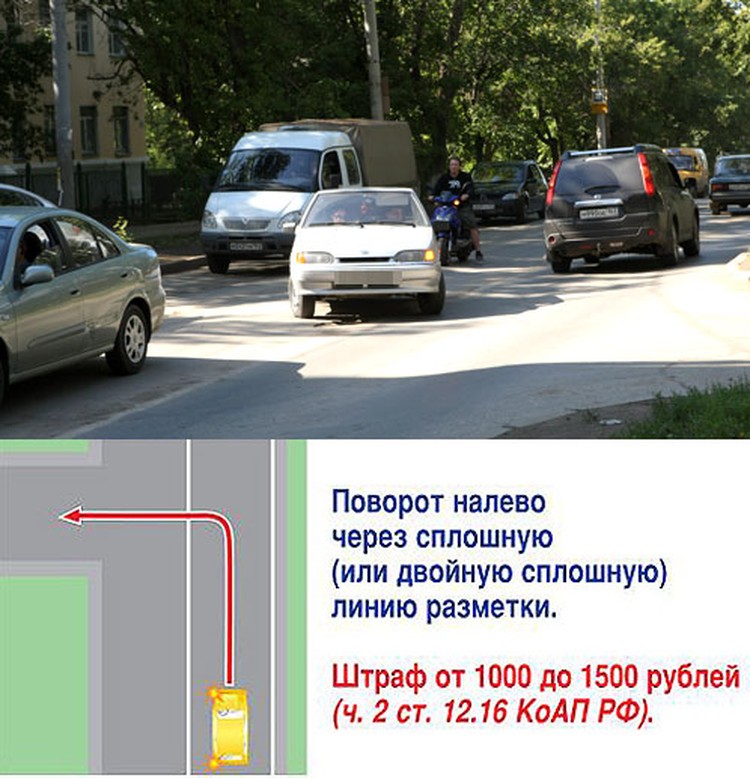
Сначала ответим на вопрос: в каких случаях запрещается выезд на сторону дороги, предназначенную для встречного движения? Ответ лежит в ПДД: согласно пункту 2 раздела 9, выезд на встречку запрещается на дорогах с двусторонним движением, имеющих четыре полосы или более. Транспортные потоки на подобных дорогах, опять-таки в соответствии с ПДД, разделяются разметкой 1.3, это белая двойная сплошная линия. Таким образом, именно за разворот и поворот налево через такую разметку можно попасть под лишение прав на год.
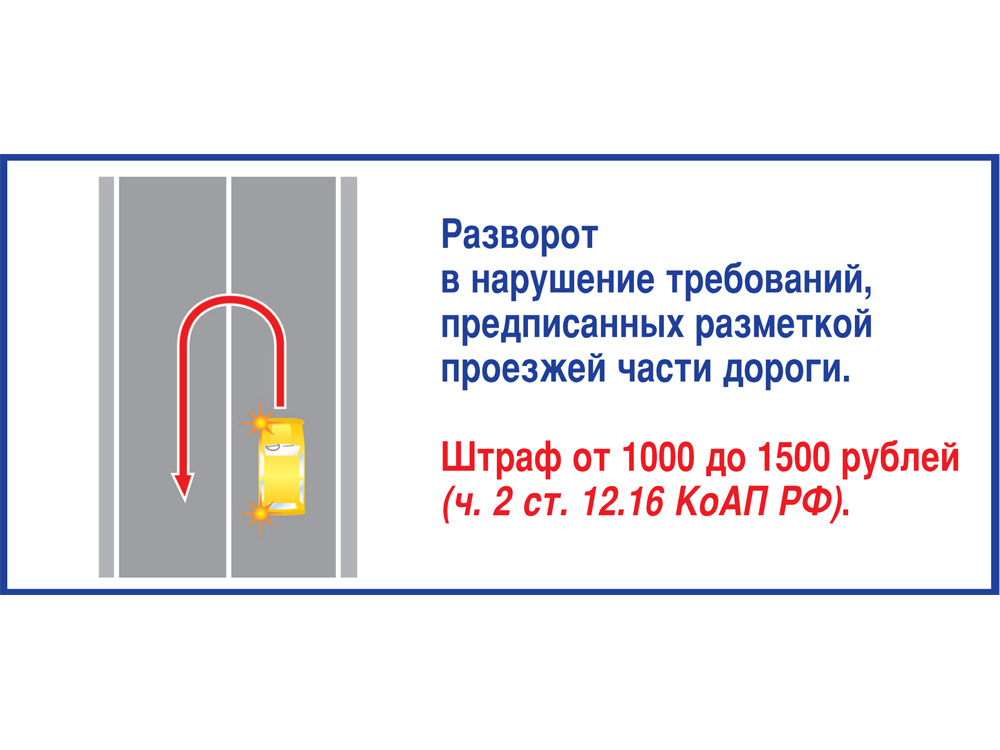
Повернул/развернулся через одну сплошную — штраф так и остался 3 МРП
Забавно? А всё потому, что на двухполосных дорогах выезд на встречную полосу Правилами не запрещается. Противоположные стороны движения разделены на таких дорогах одной сплошной, и обгон, поворот налево через неё или разворот считаются только нарушением требований разметки. Ответственность за это — 3 МРП, или 6 807 тенге в 2017 году, по статье 601 КоАП РК.
Так как одинарные сплошные разделительные линии рисуются на трассах обычно в опасных местах (на подъёмах, на участках с ограниченной видимостью) или в городах возле перекрёстков, то наблюдается очередной дисбаланс в ответственности за фактически одно и то же нарушение.
И этим непременно будут пользоваться хитрые патрульные на дорогах. Где лишение, а где штраф 3 МРП? Разница существенная.
Напоминаем, что, если разметка не видна (под снегом или стёрлась), наказывать за её пересечение полицейские не имеют права ни в каком случае.
Разворот и поворот налево на трамвайных путях
С принятием поправки и шумихой вокруг разворота/поворота у многих водителей Алматы и городов, где ещё живы трамваи, снова возникли старые вопросы: можно ли разворачиваться на трамвайных путях и отберут ли за это водительские права после внесённых поправок в КоАП? Отвечаем коротко: никаких изменений касательно движения по трамвайным путям не произошло, и наказания за такой манёвр нет. А теперь подробно. Вспомним, где Правилами запрещён разворот. Читаем пункт 12 раздела 8:
А теперь подробно. Вспомним, где Правилами запрещён разворот. Читаем пункт 12 раздела 8:
«Разворот запрещается:
— на пешеходных переходах и перекрёстках по линии тротуаров или обочин;
— в тоннелях;
— на мостах, путепроводах, эстакадах и под ними;
— на железнодорожных переездах;
— в местах с видимостью дороги менее ста метров;
— в местах расположения остановочных пунктов».
Как видно, в этом пункте нет запрета на разворот через трамвайные пути. Более того, пункт 6 раздела 8 ПДД РК чётко указывает, что «при наличии слева трамвайных путей попутного направления, расположенных на одном уровне с проезжей частью, разворот должен выполняться с них».
Уточнив детали касательно ответственности за похожие нарушения с поворотом и разворотом, мы ни в коем случае не указываем на то, что можно избежать сурового наказания. Данные нарушения одинаково опасны для жизни участников дорожного движения, невзирая на то, одна сплошная или две.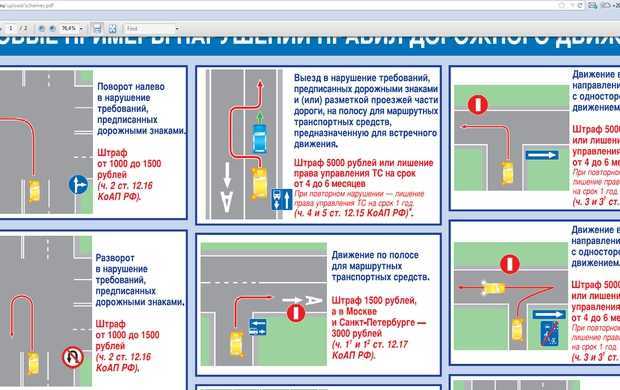
Удачи на дорогах!
Ещё по теме
-
Александр Артемьев в 24-часовой гонке в Дубае: топ-5 класса и… клин мотора
|
|
7.4K5
-
Самые крутые премьеры автосалона в Гуанчжоу
|
|
18.2K10
-
Праздник к нам приходит на красных грузовиках
|
|
9. 5K
5K1
-
Пляжи, казино и автомобили, вернувшиеся с того света
|
|
14.1K5
Цени жизнь свою и чужую-не выезжай за сплошную!
25 июня 2021 Единый День безопасности дорожного движения под девизом «Цени жизнь свою и чужую- не выезжай за сплошную!» предупреждение ДТП в результате выезда на полосу встречного движения.
В результате водители, долгое время ползущие за трактором, увидев возможность для обгона, на свой страх и риск нарушают правила.
Ответственность за въезд на встречную предусмотрена статьей ч. 9 ст.18.13 КоАП. До сих пор наиболее частое нарушение — это обгон по встречной полосе (ситуация 1). И эта ситуация прописана в ч. 9 этой статьи. За такое нарушение положен штраф от 2 до 10 БВ с лишением до 1 года либо без лишения (минимальное лишение от 3х м-в). Не спасет даже уверение в том, что вы обгоняли трактор, который ехал со скоростью 20 километров в час. Конечно, водитель трактора виноват в том, что не съехал на обочину и не пропустил все машины, которым он мешал. Но ссылка на чужое нарушение не спасет от лишения прав того, кто обгонял тихоходный транспорт по встрече.
9 ст.18.13 КоАП. До сих пор наиболее частое нарушение — это обгон по встречной полосе (ситуация 1). И эта ситуация прописана в ч. 9 этой статьи. За такое нарушение положен штраф от 2 до 10 БВ с лишением до 1 года либо без лишения (минимальное лишение от 3х м-в). Не спасет даже уверение в том, что вы обгоняли трактор, который ехал со скоростью 20 километров в час. Конечно, водитель трактора виноват в том, что не съехал на обочину и не пропустил все машины, которым он мешал. Но ссылка на чужое нарушение не спасет от лишения прав того, кто обгонял тихоходный транспорт по встрече.
Ситуация 2 — тоже квалифицируется по части 8 статьи 18.13. При повороте налево водители часто начинают маневр, не доехав до прерывистой линии. Объяснение простое — остался метр-другой до разрыва в сплошной, а хочется успеть проскочить под горящую стрелку. Но фактически водитель выезжает на полосу встречного движения. И тем самым создает опасную ситуацию. Ведь из поворота навстречу мог выезжать другой автомобиль.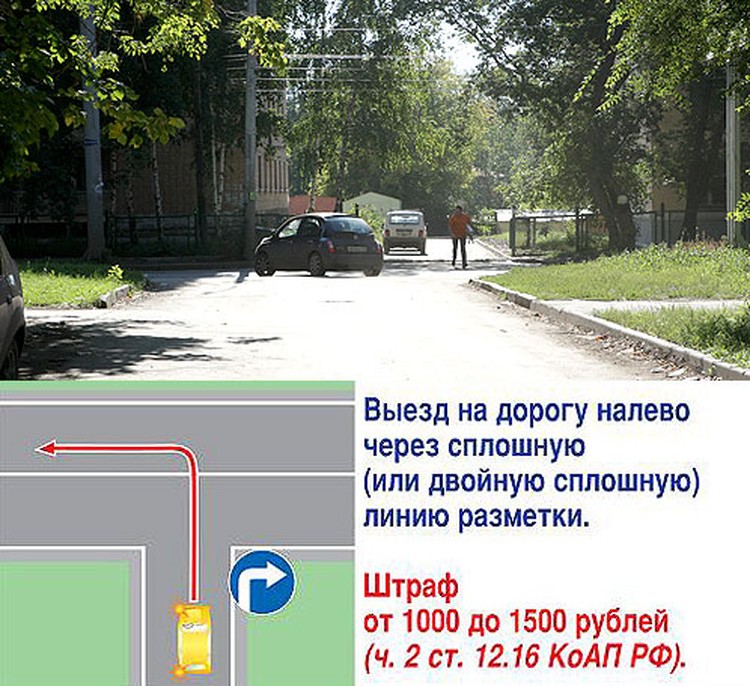 Сэкономленный метр на повороте также штраф — от 1 до 5БВ.
Сэкономленный метр на повороте также штраф — от 1 до 5БВ.
Рассмотрим часто встречающуюся ситуацию, когда единственный ряд дороги перегородил стоящий автомобиль (ситуация 3). Объезжать такое препятствие полагается справа. Но если такой возможности нет — то вы можете объехать ее и слева, предварительно уступив дорогу встречным транспортным средствам. Однако если была возможность объехать препятствие с правой стороны, а вы решили, что с левой будет быстрее или проще, то вам придется отвечать по ч. 7 ст. 18.13 — выезд на встречку, соединенный с объездом препятствия. За такое нарушение положен штраф — от 1 до 5БВ (также объезд искусственной неровности)
Особый разговор — о развороте через сплошную (ситуация 4), если водитель развернулся через сплошную, то он «совершил выезд в нарушение ПДД на сторону дороги, предназначенную для встречного движения, соединенный с разворотом». Ему грозит ответственность по части 8 статьи 18.13 — штраф от 1 до 5 БВ.
Распространенное нарушение — поворот налево через сплошную (ситуация 5). В таких случаях водитель пересекает сплошную линию и встречную полосу. И по-падает под часть 8 статьи 18.13. Подобное нарушение считается выездом на встречную полосу, соединенным с поворотом налево — штраф 1 до 5 БВ.
В таких случаях водитель пересекает сплошную линию и встречную полосу. И по-падает под часть 8 статьи 18.13. Подобное нарушение считается выездом на встречную полосу, соединенным с поворотом налево — штраф 1 до 5 БВ.
Нередко проблему составляет выезд со двора на улицу с двусторонним движением. Если на ней — сплошная линия, то левый поворот будет грубым нарушением (ситуация 6) -отвечать придется по ч.8 ст. 18.13 — за несоблюдение требований, предписанных дорожными знаками или разметкой. За это нарушение предусмотрен штраф в размере от 1 до 5 БВ.
Плавление, кипячение и возгонка – Введение в химию – 1-е канадское издание
Глава 10. Твердые и жидкие вещества
- Опишите, что происходит во время изменения фазы.
- Рассчитайте изменение энергии, необходимое для фазового перехода.
Вещества могут менять фазу — часто из-за изменения температуры. При низких температурах большинство веществ твердые; при повышении температуры они становятся жидкими; при еще более высоких температурах они становятся газообразными.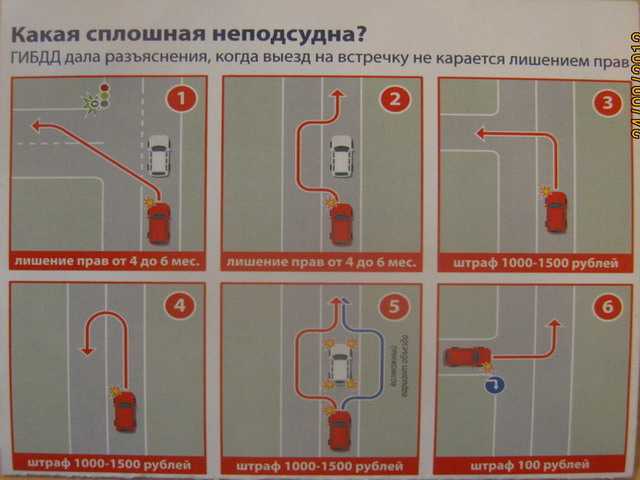
Процесс превращения твердого тела в жидкость называется плавлением (более старый термин, который вы иногда можете встретить, это слияние ). Противоположный процесс, превращение жидкости в твердое тело, называется затвердеванием . Для любого чистого вещества температура, при которой происходит плавление, известная как точка плавления , является характеристикой этого вещества. Чтобы твердое тело превратилось в жидкость, требуется энергия. Каждое чистое вещество имеет определенное количество энергии, необходимое для перехода из твердого состояния в жидкое. Эта сумма называется энтальпия плавления (или теплота плавления) вещества, представленная как Δ H плавка . Некоторые значения Δ H fus приведены в табл. 10.2 «Энтальпии плавления различных веществ»; предполагается, что эти значения относятся к температуре плавления вещества. Обратите внимание, что единицей измерения Δ H fus является килоджоуль на моль, поэтому нам нужно знать количество материала, чтобы знать, сколько энергии задействовано.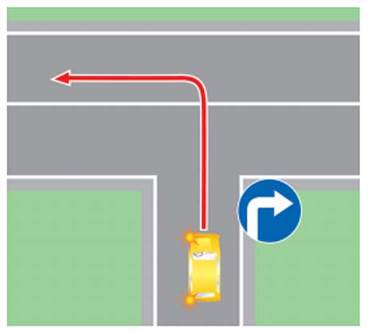 Предохранитель Δ H всегда табулируется как положительное число. Однако его можно использовать как для процессов плавления, так и для процессов затвердевания, если помнить, что плавление всегда эндотермическое (поэтому Δ H будет положительным), а затвердевание всегда экзотермическое (поэтому Δ H будет отрицательный).
Предохранитель Δ H всегда табулируется как положительное число. Однако его можно использовать как для процессов плавления, так и для процессов затвердевания, если помнить, что плавление всегда эндотермическое (поэтому Δ H будет положительным), а затвердевание всегда экзотермическое (поэтому Δ H будет отрицательный).
| Вещество (точка плавления) | Δ H сплав (кДж/моль) |
|---|---|
| Вода (0°C) | 6.01 |
| Алюминий (660°C) | 10,7 |
| Бензол (5,5°C) | 9,95 |
| Этанол (-114,3°C) | 5,02 |
| Ртуть (-38,8°C) | 2,29 |
Как изменится энергия, если 45,7 г H 2 O расплавятся при 0°C?
Решение
Δ H предохранитель H 2 O составляет 6,01 кДж/моль.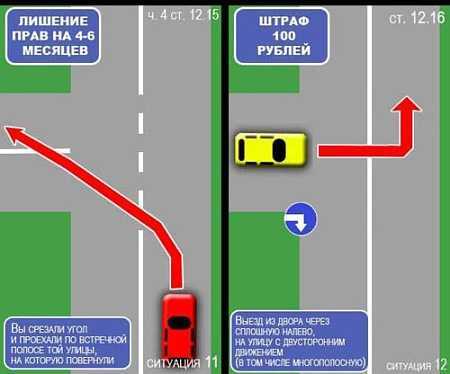 Однако наше количество дано в граммах, а не в молях, поэтому первым шагом является преобразование граммов в моли с использованием молярной массы H 2 O, которая составляет 18,0 г/моль. Тогда мы можем использовать Δ H fus в качестве коэффициента преобразования. Поскольку вещество плавится, процесс эндотермический, поэтому изменение энергии будет иметь положительный знак.
Однако наше количество дано в граммах, а не в молях, поэтому первым шагом является преобразование граммов в моли с использованием молярной массы H 2 O, которая составляет 18,0 г/моль. Тогда мы можем использовать Δ H fus в качестве коэффициента преобразования. Поскольку вещество плавится, процесс эндотермический, поэтому изменение энергии будет иметь положительный знак.
Без знака число считается положительным.
Проверь себя
Как изменится энергия, если 108 г C 6 H 6 замерзнут при 5,5°C?
Ответ
−13,8 кДж
При плавлении энергия идет исключительно на изменение фазы вещества; это не касается изменения температуры вещества. Следовательно, плавление является изотермическим процессом, поскольку вещество остается при одной и той же температуре. Только когда все вещество расплавлено, дополнительная энергия идет на изменение его температуры.
Что происходит, когда твердое тело становится жидкостью? В твердом теле отдельные частицы застревают на месте, потому что межмолекулярные силы не могут быть преодолены за счет энергии частиц. Когда поступает больше энергии (например, за счет повышения температуры), наступает момент, когда частицы имеют достаточно энергии, чтобы двигаться, но недостаточно энергии, чтобы разделиться. Это жидкая фаза: частицы все еще находятся в контакте, но могут двигаться вокруг друг друга. Это объясняет, почему жидкости могут принимать форму своих сосудов: частицы перемещаются и под действием гравитации заполняют наименьший возможный объем (если только жидкость не находится в среде с невесомостью — см. рис. 10.16 «Жидкости и гравитация»). .
Рисунок 10.16 «Жидкости и гравитация». а) Жидкость заполняет дно своего сосуда, когда она стягивается вниз под действием силы тяжести, и частицы скользят друг по другу. б) Жидкость плавает в условиях невесомости. Частицы все еще скользят друг по другу, потому что они находятся в жидкой фазе, но теперь нет гравитации, которая могла бы тянуть их вниз.
Фазовый переход между жидкостью и газом имеет некоторое сходство с фазовым переходом между твердым телом и жидкостью. При определенной температуре частицы жидкости обладают достаточной энергией, чтобы превратиться в газ. Процесс превращения жидкости в газ называется кипение (или испарение) , а процесс превращения газа в жидкость называется конденсацией . Однако, в отличие от процесса конверсии твердого тела в жидкость, на процесс конверсии жидкость/газ заметно влияет окружающее давление на жидкость, поскольку давление сильно влияет на газы. Это означает, что температура, при которой жидкость становится газом, точка кипения , может изменяться в зависимости от окружающего давления. Поэтому мы определяем нормальную температуру кипения как температура, при которой жидкость превращается в газ, когда окружающее давление составляет ровно 1 атм или 760 торр. Если не указано иное, предполагается, что точка кипения соответствует давлению в 1 атм.
Подобно фазовому переходу твердое тело/жидкость, фазовый переход жидкость/газ требует энергии. Количество энергии, необходимое для преобразования жидкости в газ, называется энтальпией парообразования (или теплотой парообразования), представленной как Δ H пар . Некоторые Δ H vap значения приведены в таблице 10.3 «Энтальпии испарения различных веществ»; предполагается, что эти значения относятся к нормальной температуре кипения вещества, которая также приведена в таблице. Единицей для Δ H vap также является килоджоуль на моль, поэтому нам нужно знать количество материала, чтобы знать, сколько энергии задействовано. Δ H vap также всегда указывается в таблице как положительное число. Его можно использовать как для процессов кипения, так и для процессов конденсации, если помнить, что кипение всегда эндотермическое (поэтому Δ H будет положительным), в то время как конденсация всегда экзотермическая (поэтому Δ H будет отрицательным).
| Вещество (нормальная температура кипения) | Δ H пар (кДж/моль) |
|---|---|
| Вода (100°C) | 40,68 |
| Бром (59,5°C) | 15,4 |
| Бензол (80,1°С) | 30,8 |
| Этанол (78,3°C) | 38,6 |
| Ртуть (357°C) | 59,23 |
Как изменится энергия при конденсации 66,7 г Br 2 (г) в жидкость при 59,5°С?
Раствор
Δ H vap Br 2 составляет 15,4 кДж/моль. Несмотря на то, что это процесс конденсации, мы все же можем использовать числовое значение Δ H vap до тех пор, пока мы понимаем, что должны отводить энергию, поэтому значение Δ H будет отрицательным. Чтобы определить величину изменения энергии, мы должны сначала перевести количество Br 2 в моли. Тогда мы можем использовать Δ H vap в качестве коэффициента преобразования.
Чтобы определить величину изменения энергии, мы должны сначала перевести количество Br 2 в моли. Тогда мы можем использовать Δ H vap в качестве коэффициента преобразования.
Поскольку процесс экзотермический, фактическое значение будет отрицательным: Δ H = −6,43 кДж.
Проверь себя
Как изменится энергия при 822 г C 2 H 5 OH(ℓ) кипятить при нормальной температуре кипения 78,3°C?
Ответ
689 кДж
Как и при плавлении, при кипении энергия идет исключительно на изменение фазы вещества; это не касается изменения температуры вещества. Так что кипение тоже изотермический процесс. Только когда все вещество закипит, дополнительная энергия идет на изменение его температуры.
Что происходит, когда жидкость становится газом? Мы уже установили, что жидкость состоит из частиц, находящихся в контакте друг с другом. Когда жидкость становится газом, частицы отделяются друг от друга, и каждая частица движется в пространстве своим путем.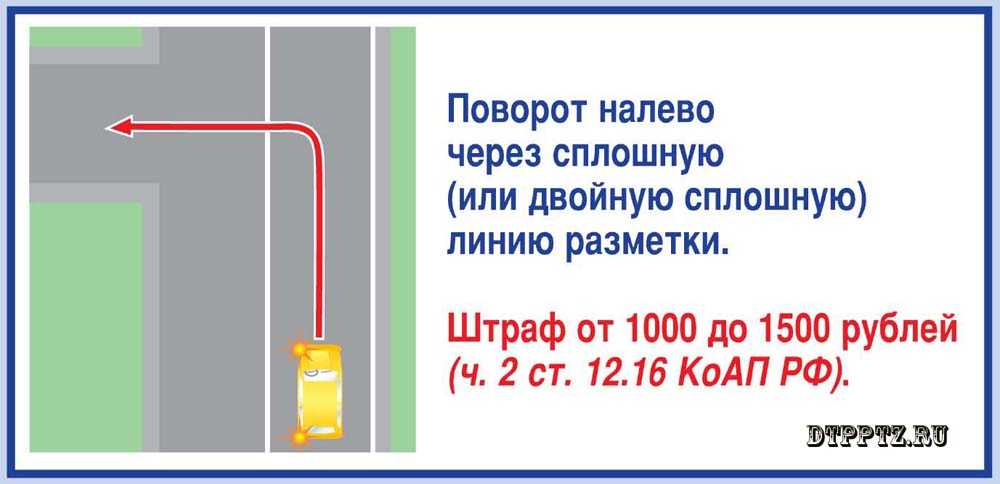 Именно так газы стремятся заполнить свои сосуды. Действительно, в газовой фазе большую часть объема занимает пустое пространство; только одна тысячная объема фактически занята веществом (см. рис. 10.17 «Жидкости и газы»). Именно это свойство газов объясняет, почему они могут сжиматься, что и рассматривается в главе 6 «Газы».
Именно так газы стремятся заполнить свои сосуды. Действительно, в газовой фазе большую часть объема занимает пустое пространство; только одна тысячная объема фактически занята веществом (см. рис. 10.17 «Жидкости и газы»). Именно это свойство газов объясняет, почему они могут сжиматься, что и рассматривается в главе 6 «Газы».
Рисунок 10.17 Жидкости и газы. В (а) частицы представляют собой жидкость; частицы находятся в контакте, но также могут перемещаться друг вокруг друга. В (b) частицы представляют собой газ, и большая часть объема на самом деле представляет собой пустое пространство. Частицы не в масштабе; на самом деле точки, представляющие частицы, будут примерно в одну тысячную меньше, чем изображено.
При некоторых обстоятельствах твердая фаза может перейти непосредственно в газовую фазу, минуя жидкую фазу, а газ может сразу стать твердым. Переход твердого состояния в газообразное называется 9.0015 сублимация , а обратный процесс называется осаждением .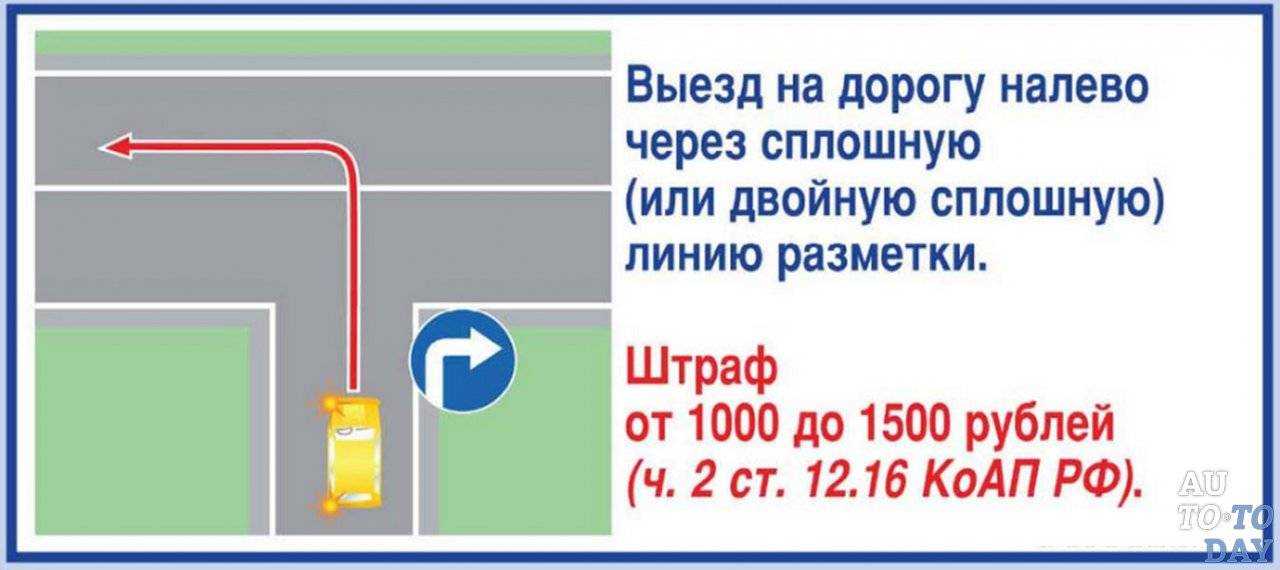 Сублимация изотермическая, как и другие фазовые переходы. Во время сублимации происходит измеримое изменение энергии; это изменение энергии называется энтальпией сублимации , представленной как Δ H к югу от . Соотношение между Δ H sub и другими изменениями энтальпии выглядит следующим образом:
Сублимация изотермическая, как и другие фазовые переходы. Во время сублимации происходит измеримое изменение энергии; это изменение энергии называется энтальпией сублимации , представленной как Δ H к югу от . Соотношение между Δ H sub и другими изменениями энтальпии выглядит следующим образом:
Δ H суб = Δ H предохранитель + Δ H пар
Таким образом, Δ H sub не всегда указывается в таблице, поскольку его можно просто рассчитать из Δ H fus и Δ H vap .
Есть несколько распространенных примеров сублимации. Известный продукт — сухой лед — на самом деле является твердым CO 2 . Сухой лед является сухим, потому что он возгоняется, при этом твердая фаза минует жидкую фазу и переходит прямо в газовую фазу. Сублимация происходит при температуре -77°С, поэтому с ней нужно обращаться осторожно. Если вы когда-нибудь замечали, что кубики льда в морозильной камере со временем становятся меньше, то это потому, что твердая вода очень медленно сублимирует. «Ожог от заморозки» на самом деле не ожог; это происходит, когда некоторые продукты, такие как мясо, медленно теряют содержание твердой воды из-за сублимации. Еда по-прежнему хороша, но выглядит неаппетитно. Снижение температуры морозильной камеры замедлит сублимацию твердой воды.
Если вы когда-нибудь замечали, что кубики льда в морозильной камере со временем становятся меньше, то это потому, что твердая вода очень медленно сублимирует. «Ожог от заморозки» на самом деле не ожог; это происходит, когда некоторые продукты, такие как мясо, медленно теряют содержание твердой воды из-за сублимации. Еда по-прежнему хороша, но выглядит неаппетитно. Снижение температуры морозильной камеры замедлит сублимацию твердой воды.
Химические уравнения могут использоваться для описания фазового перехода. В таких случаях крайне важно использовать фазовые метки на веществах. Например, химическое уравнение таяния льда для получения жидкой воды выглядит следующим образом:
H 2 O(s) → H 2 O(ℓ)
Химических изменений не происходит; однако происходит физическое изменение.
График зависимости температуры от количества подведенного тепла известен как кривая нагрева (см. рис. 10.18). Они обычно используются, чтобы визуально показать взаимосвязь между фазовыми переходами и энтальпией для данного вещества.
Рисунок 10.18 «Общая диаграмма кривой нагрева».
На рис. 10.18 [1] твердое тело приобретает кинетическую энергию и, следовательно, повышается температура по мере добавления тепла. В точке плавления добавленное тепло используется для разрушения межмолекулярных сил притяжения твердого тела вместо увеличения кинетической энергии, и поэтому температура остается постоянной. После того, как все твердое вещество расплавится, снова подведенное тепло идет на увеличение кинетической энергии (и температуры) молекул жидкости до точки кипения. В точке кипения, опять же, добавленное тепло используется для разрушения межмолекулярных сил притяжения вместо обеспечения кинетической энергии, и температура остается постоянной до тех пор, пока вся жидкость не превратится в газ.
- Фазовые превращения могут происходить между любыми двумя фазами материи.
- Все фазовые переходы происходят с одновременным изменением энергии.
- Все фазовые переходы изотермические.
- В чем разница между плавление и затвердевание ?
- В чем разница между кипящим и конденсационным ?
- Опишите молекулярные изменения, когда твердое тело становится жидкостью.
- Опишите молекулярные изменения, когда жидкость превращается в газ.
- Как изменится энергия, если 78,0 г ртути расплавятся при температуре -38,8°C?
- Как изменится энергия при затвердевании 30,8 г алюминия при 660°С?
- Как изменится энергия при кипении 111 г Br 2 при 59,5°С?
- Как изменится энергия при конденсации 98,6 г H 2 O при 100°C?
- Каждое из следующих утверждений неверно. Перепишите их так, чтобы они были правильными.
- Изменение температуры во время фазового перехода.
- Процесс превращения жидкости в газ называется сублимацией.
- Каждое из следующих утверждений неверно. Перепишите их так, чтобы они были правильными.

- Объем газа содержит только около 10% материи, а остальное — пустое пространство.
- Δ H sub равно Δ H vap .
- Напишите химическое уравнение плавления элементарного натрия.
- Напишите химическое уравнение затвердевания бензола (C 6 H 6 ).
- Напишите химическое уравнение сублимации CO 2 .
- Напишите химическое уравнение кипения пропанола (C 3 H 7 OH).
- Что такое Δ H sub из H 2 O? (Подсказка: см. Таблицу 10.2 «Энтальпии плавления различных веществ» и Таблицу 10.3 «Энтальпии испарения различных веществ».)
- Δ H sub I 2 составляет 60,46 кДж/моль, а его Δ H vap составляет 41,71 кДж/моль. Что такое Δ H fus I 2 ?
- Плавление — это фазовый переход от твердого к жидкому, тогда как затвердевание — это фазовый переход от жидкого к твердому.
- Молекулы имеют достаточно энергии, чтобы двигаться относительно друг друга, но недостаточно, чтобы полностью отделиться друг от друга.
- 890 Дж
- 10,7 кДж
-
- Температура не изменяется при изменении фазы.
- Процесс превращения жидкости в газ называется кипением; процесс превращения твердого тела в газ называется сублимацией.
- Na(s) → Na(ℓ)
- CO 2 (s) → CO 2 (g)
- 46,69 кДж/моль
Атрибуция СМИ
- «Стакан воды» © 2005 г. Дерека Дженсена под лицензией Public Domain
- «Клейтон Андерсон в невесомости» © 2010 НАСА находится под лицензией Public Domain
- Предоставлено UC Davis Chemwiki\CC-BY-NC-SA-3.0 ↵
Сублимация и осаждение — Energy Education
Energy Education
Меню навигации
ИСТОЧНИКИ ЭНЕРГИИ
ИСПОЛЬЗОВАНИЕ ЭНЕРГИИ
ЭНЕРГЕТИЧЕСКОЕ ВОЗДЕЙСТВИЕ
ИНДЕКС
Поиск
Сублимация
Рисунок 1: Кусок твердого диоксида углерода (сухой лед), сублимирующийся из твердого вещества непосредственно в газ. [1]
[1]
Сублимация — это тип фазового перехода, при котором твердое вещество сразу превращается в газ, минуя жидкую фазу. Противоположностью сублимации является осаждение из паровой фазы . Термин «сублимация» относится только к физическому изменению состояния, а не к превращению твердого вещества в газ во время химической реакции. [2]
Одним из распространенных примеров сублимации является твердый диоксид углерода, известный как сухой лед. При комнатной температуре (293 К) и давлении (1,01 бар) сухой лед сублимируется в пары углекислого газа. Сублимация — это эндотермический процесс, который происходит ниже тройной точки вещества на его фазовой диаграмме. [3] На рис. 2 показана фазовая диаграмма для диоксида углерода, где сублимация может происходить ниже тройной точки (216,55 К и 5,17 бар). [4] Это означает, что жидкий диоксид углерода возможен, просто для образования жидкости требуется 5-кратное нормальное атмосферное давление.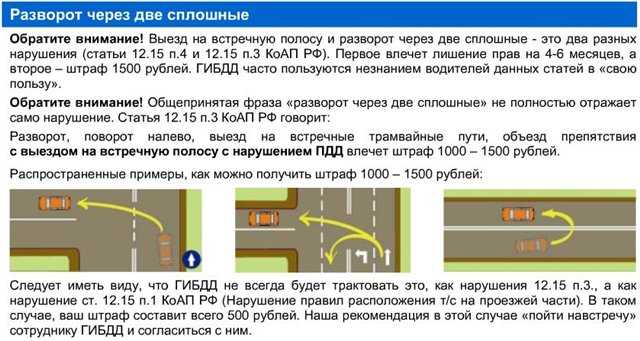 Температура и давление, при которых происходит сублимация, зависят от химических и физических свойств системы. Энергия, связанная с непосредственным переходом твердого тела в газообразное, называется скрытой теплотой сублимации.
Температура и давление, при которых происходит сублимация, зависят от химических и физических свойств системы. Энергия, связанная с непосредственным переходом твердого тела в газообразное, называется скрытой теплотой сублимации.
Сублимация происходит и со снегом. Это означает, что когда воздух особенно сухой (низкая влажность), вода превращается прямо из снега или льда в водяной пар, не будучи вообще жидкой. [2]
Рисунок 2: Фазовая диаграмма двуокиси углерода, показывающая, как сублимация происходит ниже тройной точки. [5] Более высокое давление сделало бы сухой лед «мокрым», так как образовалась бы жидкая двуокись углерода.
Посетите вики-сайт UC Davis Chem для получения дополнительной информации о сублимации.
Осаждение
Как указывалось ранее, осаждение из паровой фазы противоположно сублимации. Осаждение – это когда вещество в газообразной форме меняет свое состояние и становится твердым. Газообразное вещество получает осажденных (обычно в виде кристаллов) минуя промежуточное жидкое состояние. Примером отложения является превращение водяного пара в атмосфере непосредственно в лед, например, при образовании инея. [2]
Газообразное вещество получает осажденных (обычно в виде кристаллов) минуя промежуточное жидкое состояние. Примером отложения является превращение водяного пара в атмосфере непосредственно в лед, например, при образовании инея. [2]
Для дальнейшего чтения
- Твердое, жидкое, газообразное
- Скрытая теплота
- Удельная скрытая теплота
- Изменение фазы
- Или просмотрите случайную страницу
Ссылки
- ↑ Helmenstine, Anne Marie, Ph.D. «Определение сублимации (фазовый переход в химии)», ThoughtCo, 16 февраля 2021 г. [Онлайн]. Доступно: thinkco.com/definition-of-sublimation-phase-transition-604665. [Проверено: 12 мая 2021 г.]
- ↑ 2.0 2.1 2.2 «Сублимация и круговорот воды», USGS [онлайн]. Доступно: https://www.usgs.gov/special-topic/water-science-school/science/sublimation-and-water-cycle?qt-science_center_objects=0#qt-science_center_objects [Проверено: 13 мая 2021 г.
