Содержание
Коррозия металлов — что это такое? Виды и примеры
Поможем понять и полюбить химию
Начать учиться
Всякое явление или процесс вокруг нас связан с химией. Скажем, ржавление железа. Хоть раз в жизни вы наверняка задумывались, почему одни металлы ржавеют и разрушаются, а другие — нет. И что такого особенного в нержавеющей стали, что этот процесс ей нипочем? Обо всем это мы и поговорим в сегодняшней статье.
Коротко о главном
Коррозия металлов или ржавление в химии — это явление, которое возникает из-за взаимодействия металлической пластинки с веществами окружающей среды (кислородом воздуха или кислотами, с которыми может реагировать металлическое изделие).
Обычно окисляются металлы, включая железо, которые находятся левее водорода в ряду напряжений.
Чаще всего встречаются химическая и электрохимическая коррозии. Чтобы понять, чем они отличаются друг от друга, давайте сравним их по нескольким критериям в таблице ниже.
Чтобы понять, чем они отличаются друг от друга, давайте сравним их по нескольким критериям в таблице ниже.
|
Таблица 1. Сравнение химической и электрохимической коррозии металлов |
||
|---|---|---|
|
Признаки сравнения |
Химическая коррозия |
Электрохимическая коррозия |
|
Определение |
Разрушение металлов в из-за взаимодействия с газами или растворами, которые не проводят электрический ток |
Разрушение металла, при котором возникает электрический ток в воде или среде другого электролита |
|
Агрессивные реагенты |
O2, пары H2O, CO2, SO2, Cl2 |
Растворы электролитов |
|
Примеры |
3Fe + 2O2 → Fe3O4 |
4Fe + 3O2 + 6H2O = 4 Fe(OH)3 При контакте железа с цинком коррозии подвергается цинк: А (+) на цинке: Zn0 — 2e— = Zn2+. К (–) на железе: 2H+ + 2e— = H2. |
Защитить металл от коррозии можно по-разному: покрытием защитными материалами, электрохимическими методами, шлифованием и т. д. Далее — подробно обо всем этом.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Что такое коррозия
Коррозия — это самопроизвольное разрушение элементов, чаще всего металлов, под действием химического или физико-химического влияния окружающей среды.
Иными словами, из-за химического воздействия железо начинает ржаветь. Это весьма сложный процесс, который состоит из несколько этапов. Но суммарное уравнение коррозии выглядит так:
4Fe + 6H2O (влага) + 3O2 (воздух) = 4Fe(OH)3.
Часто под коррозией понимают химическую реакцию между материалом и средой либо между их компонентами, которая протекает на границе раздела фаз. Обычно это окисление металла. Например:
3Fe + 2О2 = Fe3O4;
Fe + H2SO4 = FeSО4 + Н2.
Некоторые металлы, даже активные, покрываются плотной оксидной пленкой при коррозии. Это одна из их характерных черт. Оксидная пленка не дает окислителям проникнуть в более глубокий слой и поэтому защищает металл от коррозии. Алюминий обычно устойчив при контакте с воздухом и водой, даже горячей. Тем не менее, если поверхность алюминия покрыть ртутью, то образуется амальгама. Она разрушает оксидную пленку, и алюминий начинает быстро превращаться в белые хлопья метагидроксида алюминия:
Коррозии подвергаются и многие малоактивные металлы. Например, поверхность медного изделия покрывается патиной — зеленоватым налетом. Это происходит потому, что на ней образуются смеси основных солей.
Например, поверхность медного изделия покрывается патиной — зеленоватым налетом. Это происходит потому, что на ней образуются смеси основных солей.
Виды коррозии металлов
Химическая коррозия
Химическая коррозия — это процесс разрушения металла, который связан с реакцией между металлом и коррозионной средой.
Химическая коррозия протекает без воздействия электрического тока, и в результате этой реакции металлы окисляются. Этот вид коррозии можно разделить на два подвида:
-
газовая коррозия — металл корродирует под воздействием различных газов при высоких температурах;
-
коррозия в жидкостях — неэлектролитах.
Их них более распространенной считают газовую коррозию. Она протекает во время прямого контакта твердого тела с активным газом воздуха. Чаще всего это кислород. В результате на поверхности тела образуется пленка продуктов химической реакции между веществом и газом. Дальше эта пленка мешает контакту корродирующего материала с газом. При высоких температурах газовая коррозия развивается интенсивно. Возникшая при этом пленка называется окалиной, которая со временем становится толще.
В результате на поверхности тела образуется пленка продуктов химической реакции между веществом и газом. Дальше эта пленка мешает контакту корродирующего материала с газом. При высоких температурах газовая коррозия развивается интенсивно. Возникшая при этом пленка называется окалиной, которая со временем становится толще.
Важную роль в процессе коррозии играет состав газовой среды. Но для каждого металла он индивидуален и изменяется с переменой температур.
Электрохимическая коррозия
Электрохимическая коррозия — это разрушение металла, которое протекает при его взаимодействии с окружающей средой электролита.
Этот вид коррозии считают наиболее распространенным. Самым важным происхождением электрохимической коррозии является то, что металл неустойчив в окружающей среде с точки зрения термодинамики. Вот несколько ярких примеров этой реакции: ржавчина в трубопроводе, на обшивке днища морского судна и на различных металлоконструкциях в атмосфере.
В механизме электрохимической коррозии обычно выделяют два направления: гомогенное и гетерогенное. Разберем их подробнее в таблице ниже.
|
Гомогенный механизм электрохимической коррозии |
Гетерогенный механизм электрохимической коррозии |
|---|---|
|
Поверхность металла рассматривается как однородный слой. |
У твердых металлов поверхность неоднородна из-за структуры сплава, в котором атомы по-разному расположены в кристаллической решетке. |
|
Растворение металла происходит из-за термодинамической возможности для катодного или анодного процессов. |
Неоднородность можно наблюдать при наличии в сплаве каких-либо включений. |
|
Скорость, с которой протекает электрохимическая коррозия, зависит от времени протекания процесса. |
В электрохимической коррозии протекает одновременно два процесса на аноде и на катоде, которые зависят друг от друга. Растворение основного металла происходит только на анодах. Анодный процесс заключается в том, что ионы металла отрываются и переходят в раствор:
Fe → Fe2+ + 2e.
В результате происходит реакция окисления металла. В данном случае анод заряжается отрицательно.
При катодном процессе избыточные электроны переходят в молекулы или атомы электролита, которые, в свою очередь, восстанавливаются. На катоде идет реакция восстановления. Он носит заряд положительного электрода.
O2 + 2H2O + 4e → 4OH—
2H+ + 2e → H2
Торможение одного процесса приводит к торможению и другого процесса. Окисление металла может происходить только в анодном процессе.
Окисление металла может происходить только в анодном процессе.
Бесплатные занятия по английскому с носителем
Занимайтесь по 15 минут в день. Осваивайте английскую грамматику и лексику. Сделайте язык частью жизни.
Как защитить металлы от коррозии
От коррозии можно и нужно защищаться. Чтобы уберечь металлы от этой реакции, их покрывают защитными материалами, обрабатывают электрохимическими методами, шлифованием и т. д. Рассмотрим все эти способы подробнее.
Способ № 1. Защитные покрытия.
Для защиты от коррозии металлические изделия покрывают другим металлом, т. е. производят никелирование, хромирование, цинкование, лужение и т. д. Еще один вариант защиты — покрыть поверхность металла специальными лаками, красками, эмалями.
Способ № 2. Легирование.
Легирование — это введение добавок, которые образуют защитный слой на поверхности металла. Например, при легировании железа хромом и никелем получают нержавеющую сталь.
Например, при легировании железа хромом и никелем получают нержавеющую сталь.
Способ № 3. Протекторная защита.
Протекторная защита — это способ уберечь металл от коррозии, при котором металлическое изделие соединяют с более активным металлом. Этот второй металл в итоге и разрушается в первую очередь.
Способ № 4. Электрохимическая защита.
Чтобы защитить металлы от электрохимической коррозии, нейтрализуют ток, который возникает при ней. Это делают с помощью постоянного тока, который пропускают в обратном направлении.
Способ № 5. Изменение состава среды путем добавления ингибиторов.
Для защиты от коррозии используют специальные средства, которые ее замедляют — ингибиторы. Они изменяют состояние поверхности металла — образуют труднорастворимые соединения с катионами металла. Защитные слои, образованные ингибиторами, всегда тоньше наносимых покрытий.
Способ № 6. Замена корродирующего металла на другие материалы: керамику и пластмассу.
Способ № 7. Шлифование поверхностей изделия.
Проверьте себя
-
Что такое коррозия?
-
Где в повседневной жизни можно встретить ржавление железа и других металлов? Приведите примеры.
-
Гидроксид железа Fe(OH)3 называют:
а ржавчина;
б) окалина;
в) патина.
-
Что является причиной возникновения коррозии?
-
Чем отличаются химический и электрохимический типы коррозии?
-
Что такое коррозионная среда?
Узнайте все о коррозии металлов и разберитесь в других темах за 9 класс на онлайн-курсах по химии в Skysmart! Наши преподаватели помогут выяснить, где скрываются пробелы в знаниях, и восполнить их. Никаких скучных задач и сухих лекций — только интерактивные упражнения, опыты и теория простым языком. Все это поможет разобраться даже в тех темах, которые не давались в школе. Ждем на бесплатном вводном уроке!
Никаких скучных задач и сухих лекций — только интерактивные упражнения, опыты и теория простым языком. Все это поможет разобраться даже в тех темах, которые не давались в школе. Ждем на бесплатном вводном уроке!
Татьяна Сосновцева
К предыдущей статье
Водородный показатель pH
К следующей статье
Химическое равновесие
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
-
Выявим пробелы в знаниях и дадим советы по обучению
-
Расскажем, как проходят занятия
-
Подберём курс
Электрохимическая коррозия: причины, типы, скорость протекания
Электрохимическая коррозия относится к наиболее часто встречающимся процессам постепенного разрушения металла.
Как мы знаем, наше окружение наполнено электричеством.
В зависимости от среды, меняются показатели проводимости. Не отличается то, что при контакте с такой средой сталь начинает постепенно портиться.
У процесса есть несколько важных отличий.
В первую очередь – неодновременное протекание восстановления окислительного процесса и ионизации атомов металла.
На интенсивность распространения при этом влияет такой параметр, как электродный потенциал металла.
Главная причина электрохимической коррозии в том, что большинство металлов проявляют термодинамическую неустойчивость.
Примеры распространения коррозии такого типа встречаются в воде, почве, на открытом воздухе.
Она часто становится причиной потери прочности и постепенного разрушения металла на днище судов, трубопроводов, опор ЛЭП и других объектов.
Если говорить о типах электрохимической коррозии, то называют 3 разновидности:
- щелевые поражения;
- питтинги;
- межкристаллическое повреждение.

Повреждаться могут разные типы металлов в зависимости от их расположения. Ржавчина появляется при контакте со стоячей и текущей водой, в местах соединения разных металлов, а также на сварных швах.
Какие механизмы отвечают за протекание электрохимической коррозии
Такое повреждение металла проводится двумя механизмами – гомогенным и гетерогенным. Рассмотрим каждый из них подробно.
- Гомогенный. Первоначально затрагивается поверхностный слой металлического изделия. Постепенно металл начинает растворяться под действием актов – катодного или анодного. На протяжении определенного времени происходит миграция катода и анода. Со временем процесс ускоряется. Особенность гомогенного механизма в том, что затрагивает как твердые, так и жидкие металлы. Меняется только скорость течения.
- Гетерогенный. У большинства твердых металлов не наблюдается гомогенной поверхности. Это связано с тем, что в самом материале состав кристаллической решетки может отличаться.
 Также как и в описанном выше случае, формируется анодный и катодный процессы, металл начинает постепенно разрушаться.
Также как и в описанном выше случае, формируется анодный и катодный процессы, металл начинает постепенно разрушаться.
У такого вида процесса есть несколько особенностей.
В первую очередь – четкое деление на катодный и анодный процесс. Один из основных факторов, влияющих на их скорость протекания относительно друг друга – это время.
Схема электрохимической коррозии
В зависимости от типа металла, коррозия может быть локализована на отдельных участках. Также наблюдается растворение поверхностного слоя на анодах, что позволяет поражению затронуть обширные площади.
Здесь появляется еще одна особенность протекания процесса – формирование гальванических элементов. Это происходит из-за специфики структуры поверхности, на которой присутствуют микроэлектроды.
Из-за чего начинает развиваться коррозия
После того, как мы рассмотрели суть электрохимической коррозии, пришло время обратить внимание на причины распространения коррозии.
Среди них три распространенные:
- Сплав имеет неоднородную структуру. В большинстве сплавов поверхность негомогенная, потому что в кристаллической решетке присутствуют посторонние включения. Ухудшает ситуацию и присутствие пор макро и микротипа. Это приводит к тому, что продукты коррозии также начинают образовываться неравномерно.
- Неоднородная среда, в которой находится металл. Чтобы коррозия протекла быстрее, важен фактор доступа окислителя. Электрохимическая реакция может быть ускорена.
- Отличие физических условий. Коррозия усиливается в том случае, если происходит облучение, в среде присутствуют блуждающие тока. Негативно влияет и температура, особенно при перепадах. В таком случае разница между холодными и теплыми местами становится причиной появления анода.
Именно по причине различия в критических факторах, скорость электрохимической коррозии может сильно меняться.
Главные внутренние факторы протекания электрохимической коррозии
На интенсивность распространения коррозийного поражения влияют две группы факторов – внешние и внутренние.
Текущее состояние поверхности металла
Когда поверхность металла неровная, коррозийный процесс протекает намного интенсивнее. Если на поверхности присутствуют небольшие выступы, они начинают накапливать воду.
Это может негативно повлиять на интенсивность распространения.
Чтобы не допустить такого фактора, важно использовать отшлифованный или отполированный металл.
Когда сталь гладкая, вода не так сильно повреждает ее, потому что постепенно происходит формирование равномерной пленки по всей поверхности.
Также хорошим средством для уменьшения поражения становится применение пассивирования, а также ряд других способов.
Степень термодинамической стойкости металла
Разные виды материалов отличаются разными показателями термодинамической устойчивости.
Наиболее стойкие разновидности материала не разрушаются при помещении в агрессивную среду.
Чтобы понять, есть ли у металла склонность к коррозии под действием термодинамических факторов, измеряют потенциал анодного и катодного процесса, а также изобарно-изотермического.
Именно такой фактор оказывает большое влияние на потенциальное воздействие среды на постепенное развитие коррозии.
К сожалению, у большинства представленных в продаже марок металлов стойкость невысокая. Есть и неустойчивые разновидности, у которых этот риск нивелируется благодаря склонности к образованию пассивных пленок на поверхности.
Кристаллографическая структура
Оказывает прямое воздействие на металл.
Как известно, атомы в кристаллической решетке располагаются по-разному. Лучше защищены те разновидности, у которых атомы упакованы неплотно.
Особенности решетки также учитывают при планировании защиты материала методом создания на нем специальных пленок. И пленка и сам основной материал должны четко соответствовать по составу друг другу или быть максимально приближенными.
В этом случае исключается появление напряжения, которое негативно отражается на текущем состоянии заготовки. Если контакт с агрессивной средой все-таки происходит, материал начинает разрушаться слой за слоем.
Гетерогенность
Этот фактор рассматривается в непосредственной связи с величиной зерна металла.
Если в сплаве есть выраженные анодные включения, они сильно влияют на ускорение протекания коррозии.
Катодные включения не столь опасны, потому что на интенсивности процесса не отражаются. Величина зерна как фактор риска рассматривается не так часто и этим показателем можно пренебречь.
Не стоит сбрасывать со счетов и механические факторы
Важно понимать, что многие конструкции из металла используются под постоянным напряжением.
К этой категории относится повышенное внутреннее напряжение, когда сильно увеличивается риск деформации.
Негативно влияют на качество металла также воздействие истирания, периодические контакты с другими металлическими изделиями.
Такой фактор оказывает значительное влияние на интенсивность распространения повреждения.
Даже если само сырье первоначально обладало стойкостью к потенциальным повреждениям, в таком случае она уменьшится – формируемые пленки просто не будут закрепляться на поверхности.
Потому лучше сразу исключить это условие электрохимической коррозии – постараться не использовать металлоконструкции под пиковыми сильными нагрузками, не допускать возникновения трения и соприкосновения между собой стальных деталей.
Основные внешние факторы электрохимической коррозии
Кроме внутренних, на металл также влияют и внешние факторы.
Они могут не только ускорять, но и замедлять процесс, а также влиять на характер его протекания.
К ним относятся следующие:
- Температура. Температура сильно влияет на то, как себя ведет металл в разных условиях. От нее сильно зависит то, насколько быстро будут растворяться вторичные продукты коррозии. Среди других особенностей – запуск и стимуляция диффузионных процессов в металле, создание перенапряжения на электродах и другие проявления. Когда металлическое изделие помещается в растворы с кислородной деполяризацией, по мере прогрева электролита диффузия окислителя ускоряется.
 На фоне этого наблюдается сильное снижение перенапряжения ионизации кислорода.
На фоне этого наблюдается сильное снижение перенапряжения ионизации кислорода.
Если деталь помещается в растворы неокисляющихся кислот, наблюдается коррозия с водородной деполяризацией.
Повышение температуры уменьшает скорость распространения повреждений, потому что сильно снижается перенапряжение водорода.
Отдельно стоит отметить ситуацию, когда металл уже покрывается специальной защитной пленкой. В этом случае сам тип пленки будет влиять на то, как именно она поведет себя при контакте с разными видами внешних угроз, в том числе, с повышением температуры.
Нагрев и охлаждение могут отразиться на состоянии катодов и анодов через их внутренние процессы.
В некоторых случаях полярность электродов значительно меняется.
Как мы уже отмечали выше, проблемы могу возникать из-за того, что разные участки детали нагреты до отличающихся друг от друга температур.
В этом случае стремительно увеличивается количество термогальванических пар, стимулирующих распространение коррозии на новые участки.
- Уровень рН раствора, в который помещен металл. Такой показатель как рН указывает, насколько в растворе будут активными ионы водорода, и как быстро коррозия будет распространяться по материалу. Это опасно, потому что может непредсказуемо менять потенциал катодных процессов, формирование окисных пленок. Также создается значительное перенапряжение реакции на электродах. Рекомендуется не допускать контакта металла со средами, у которых показатель рН высокий.
Если по каким-то причинам металлическая заготовка оказалась помещена в раствор, большое значение будет иметь скорость, с которой он движется, а также само наличие внутренних колебаний.
Заранее определить точное воздействие будет сложно по той причине, что всегда непросто предсказать, как поведут себя нейтральные электролиты.
Cчитается, что при смешении электролита, меняются показатели диффузии кислорода, что значительно отражается на процессе протекания коррозии.
Можно уделять меньше внимания скорости движения электролита в том случае, если вы имеете дело со средами повышенной кислотности.
На них подобное поражение оказывает минимум влияния.
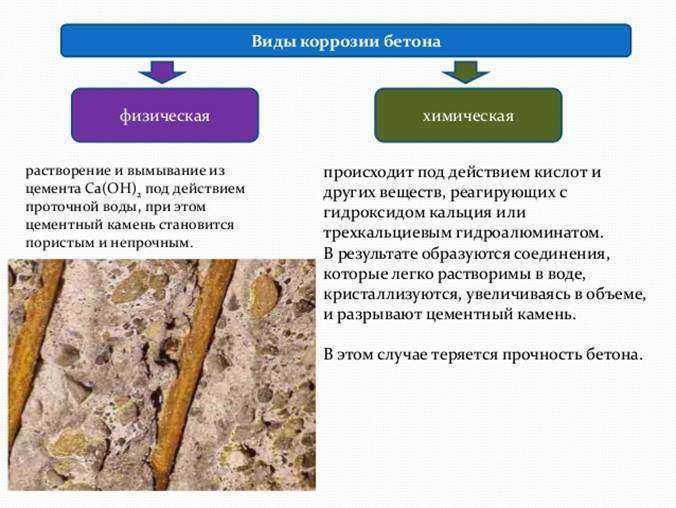
Чем отличаются анодный и катодный процессы
Если вы внимательно проследите за тем, как работает гальванический элемент, то увидите, что в нем протекают сразу два связанных друг с другом процесса – анодный и катодный.
Рассмотрим их более подробно.
Анодный процесс
В химии показывается формулой Fe → Fe2+ + 2e. Она показывает, что постепенно запускается окисление, ионы металла начинают переход в раствор.
Катодный процесс
Может протекать по-разному.
В частности, переизбыток электронов решается ассимиляцией атомами электролита и его молекул. На фоне этого происходит восстановительная реакция непосредственно на самом катоде.
Формула будет зависеть от того, в каких условиях протекает реакция.
Так при наличии водородной деполяризации можно записать процесс как 2 H+ + 2e → h3.
Важно понимать, что оба процесса сильно связаны друг с другом под влиянием кинетического фактора.
С течением времени может происходить взаимное замедление или ускорение анодного или катодного процесса. При этом сам анод всегда будет оставаться тем местом, на котором формируется коррозия металла.
Во время анализа протекания процесса коррозии часто обращают внимание на электропроводящие фазы и момент после их соприкосновения.
Обычно одна фаза имеет положительный заряд, в то время как другая – отрицательный. Это приводит к появлению разности потенциалов.
Таким образом возникает ДЭС или как его часто называют ученые – двойной электрический слой с ассиметричным расположением частиц в местах, где фазы разделяются.
Опасным для металла становится скачок потенциалов. Он может стимулироваться двумя центральными причинами:
- Большая накопленная энергия гидратации. В таком случае наблюдается отрыв ионов металла и постепенное перетекание их в раствор. На поверхности в результате остается аналогичное число электронов, заряд становится отрицательным.
 Далее, в соответствии с законами физики, наблюдается перетекание катионов из раствора, формируется ДЭС на границе, как мы уже описывали выше.
Далее, в соответствии с законами физики, наблюдается перетекание катионов из раствора, формируется ДЭС на границе, как мы уже описывали выше. - Разряжение катионов электролита. В результате металл начинает стремительно принимать положительный заряд. ДЭС появляется из-за активности анионов раствора в контакте с катионами электролита.
Что происходит в том случае, если поверхностный слой металла совсем не имеет определенного заряда?
В таком случае ДЭС наблюдаться не будет, возникнет явление нулевого заряда.
Его потенциал будет отличаться в зависимости от того, с каким металлом вам приходится работать.
Описанный процесс значительно отражается на том, как протекает коррозия и как быстро она захватывает все новые и новые участки металла.
В современной науке нет средств, которые могли бы точно измерить величину скачка потенциала, значит и процесс формирования электродвижущей силы оказывается на таким интенсивным.

Если рассматривать вопросы, связанные с процессом поляризации, можно написать отдельную статью на эту тему.
Потому далее мы рассмотрим другой важный показатель – поляризацию.
Поляризация и ее влияние на скорость протекания коррозии
Процесс поляризации связан с интенсивностью распространения электрохимической коррозии.
Этот показатель отражает, насколько сильное перенапряжение наблюдается на определенном участке.
Принято выделять три вида поляризации:
- Электрохимическая. Чаще всего наблюдается в ситуации, когда катодный и анодный процессы начинают замедляться.
- Фазовая. Возникает в том случае, если на поверхности материала формируется новая фаза.
- Концентрационная. Этот процесс появляется в том случае, если есть очень малые показатели скорости отвода продуктов коррозии, а также подхода деполяризатора.
Особенности поляризации также стоит учитывать в том случае, если вы заинтересованы в дополнительной защите металлов от постепенного разрушения.
Обеспечиваем эффективную защиту от коррозии
Наша компания предлагает заказчикам защиту металлоконструкций разных типов от коррозии.
Мы используем методику горячего цинкования.
В пользу работы с нами говорит сразу несколько факторов:
- Опыт работы с 2007 года, есть постоянные заказчики.
- Большие производственные площади. Три цеха для горячего цинкования, мощность 120 тысяч тонн в год.
- Универсальность. Работаем со множеством видов изделий благодаря установленной на предприятии самой глубокой ванны в ЦФО – 3,43 метра.
Мы используем в процессе проверенное европейское оборудование. Даем гарантию соответствия качества товаров требованиям ГОСТ 9.307-89.
Чтобы получить дополнительные консультации и ответы на интересующие вас вопросы, звоните нам или оставляйте заявку на сайте.
Вернуться к статьям
Поделиться статьей
Что такое коррозия? — Определение и предупреждение
Коррозия – это когда очищенный металл естественным образом преобразуется в более стабильную форму, такую как его оксидное, гидроксидное или сульфидное состояние, что приводит к порче материала.
Эта статья является одной из серии часто задаваемых вопросов (FAQ) TWI.
Содержание
Нажмите на ссылки ниже, чтобы перейти к разделу руководства:
- Причины
- Типы
- Эффекты
- Как предотвратить
TWI
TWI является организацией, основанной на отраслевом членстве. Эксперты TWI могут предоставить вашей компании расширение ваших собственных ресурсов. Наши специалисты стремятся помочь промышленности повысить безопасность, качество, эффективность и прибыльность во всех аспектах технологии соединения материалов. Промышленное членство в TWI в настоящее время распространяется на более чем 600 компаний по всему миру, охватывающих все отрасли промышленности.
Вы можете узнать больше, связавшись с нами ниже:
Металл подвергается коррозии, когда он вступает в реакцию с другим веществом, таким как кислород, водород, электрический ток или даже с грязью и бактериями.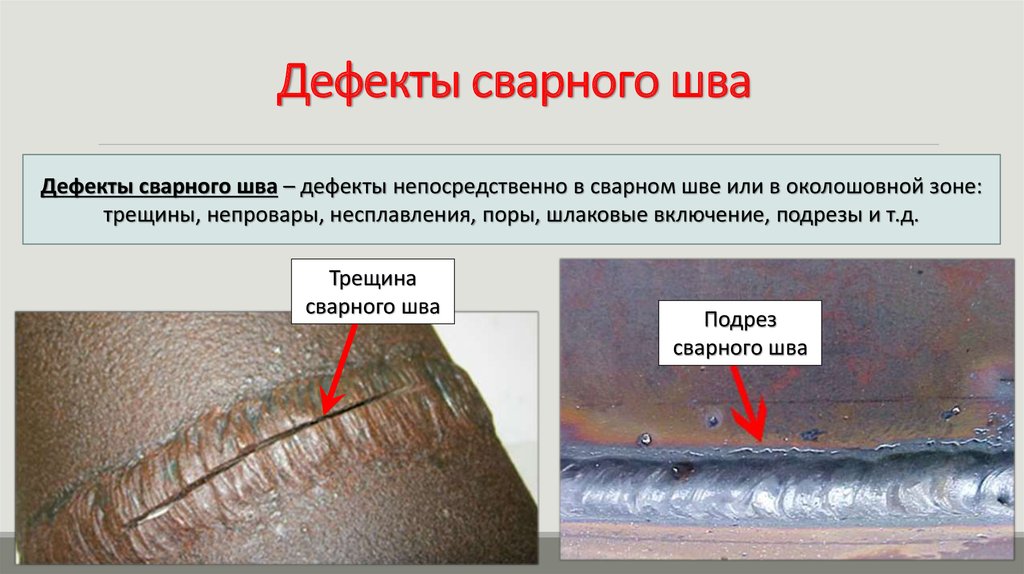 Коррозия также может возникнуть, когда металлы, такие как сталь, подвергаются слишком большому напряжению, что приводит к растрескиванию материала.
Коррозия также может возникнуть, когда металлы, такие как сталь, подвергаются слишком большому напряжению, что приводит к растрескиванию материала.
Коррозия железа
Наиболее распространенный тип коррозии железа возникает при воздействии кислорода и воды, что приводит к образованию красной окиси железа, обычно называемой ржавчиной. Ржавчина также может воздействовать на сплавы железа, такие как сталь. Ржавление железа также может происходить, когда железо реагирует с хлоридом в среде, лишенной кислорода, в то время как зеленая ржавчина, являющаяся другим типом коррозии, может образовываться непосредственно из металлического железа или гидроксида железа.
Равномерная коррозия
Это наиболее распространенная форма коррозии, которая обычно происходит равномерно на больших участках поверхности материала.
Точечная коррозия
Язвенную коррозию, одну из наиболее агрессивных форм коррозии, трудно предсказать, обнаружить или охарактеризовать. Этот локализованный тип коррозии возникает, когда локальная анодная или катодная точка образует коррозионную ячейку с окружающей поверхностью. Эта яма может создать отверстие или полость, которые обычно проникают в материал в вертикальном направлении вниз от поверхности.
Этот локализованный тип коррозии возникает, когда локальная анодная или катодная точка образует коррозионную ячейку с окружающей поверхностью. Эта яма может создать отверстие или полость, которые обычно проникают в материал в вертикальном направлении вниз от поверхности.
Питтинговая коррозия может быть вызвана повреждением или разрывом оксидной пленки или защитного покрытия, а также может быть вызвана неоднородностью структуры металла. Эта опасная форма коррозии может привести к разрушению конструкции, несмотря на относительно небольшие потери металла.
Щелевая коррозия
Эта форма коррозии возникает в местах с ограниченным доступом кислорода, например, под шайбами или головками болтов. Эта локальная коррозия обычно возникает из-за разницы в концентрации ионов между двумя участками металла. Застойная микросреда препятствует циркуляции кислорода, что останавливает репассивацию и вызывает накопление застойного раствора, сдвигая баланс pH от нейтрального.
Дисбаланс между щелью и остальным материалом способствует высокой скорости коррозии. Щелевая коррозия может иметь место при более низких температурах, чем точечная коррозия, но ее можно свести к минимуму за счет правильной конструкции соединения.
Щелевая коррозия может иметь место при более низких температурах, чем точечная коррозия, но ее можно свести к минимуму за счет правильной конструкции соединения.
Межкристаллитная коррозия
Межкристаллитная коррозия возникает, когда на границах зерен присутствуют примеси, образующиеся при затвердевании сплава. Это также может быть вызвано обогащением или обеднением легирующим элементом границ зерен. Этот тип коррозии происходит вдоль зерен или рядом с ними, влияя на механические свойства металла, несмотря на то, что основная масса материала остается неизменной.
Коррозионное растрескивание под напряжением (SCC)
Коррозионное растрескивание под напряжением относится к росту трещин из-за коррозионной среды, которая может привести к разрушению пластичных металлов под действием растягивающего напряжения, особенно при высоких температурах. Этот тип коррозии чаще встречается у сплавов, чем у чистых металлов, и зависит от конкретной химической среды, при которой для катастрофического растрескивания требуются лишь небольшие концентрации активных химических веществ.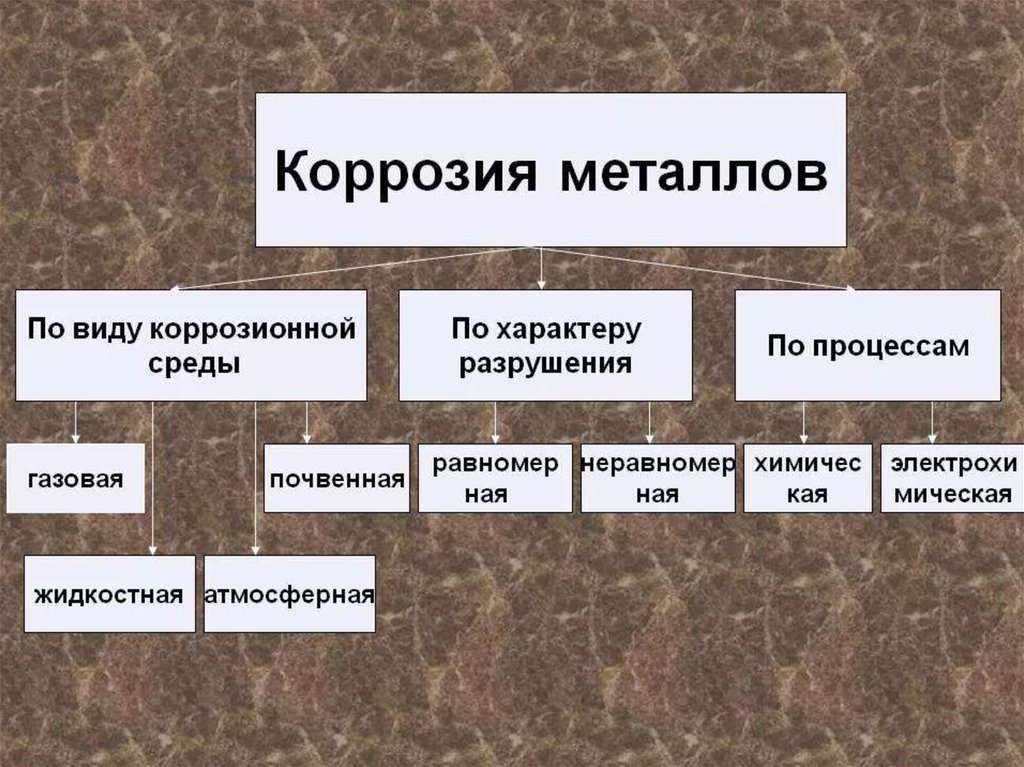
Гальваническая коррозия
Эта форма коррозии возникает, когда два разных металла с физическим или электрическим контактом погружаются в общий электролит (например, соленую воду) или когда металл подвергается воздействию электролита с различной концентрацией. Когда два металла погружены вместе, это известно как гальваническая пара, более активный металл (анод) подвергается коррозии быстрее, чем более благородный металл (катод). Гальванический ряд определяет, какие металлы корродируют быстрее, что полезно при использовании расходуемого анода для защиты конструкции от коррозии.
Ежегодные мировые затраты на коррозию металлов оцениваются более чем в 2 триллиона долларов, но эксперты считают, что 25-30% можно предотвратить с помощью надлежащей защиты от коррозии. Плохо спланированные строительные проекты могут привести к необходимости замены проржавевшей конструкции, что является пустой тратой природных ресурсов и противоречит глобальным опасениям по поводу устойчивости. Кроме того, коррозия может привести к проблемам с безопасностью, гибели людей, дополнительным косвенным затратам и ущербу для репутации.
Кроме того, коррозия может привести к проблемам с безопасностью, гибели людей, дополнительным косвенным затратам и ущербу для репутации.
Существует несколько экономичных способов предотвращения коррозии, в том числе:
- Используйте неагрессивные металлы, такие как нержавеющая сталь или алюминий
- Убедитесь, что металлическая поверхность остается чистой и сухой
- Используйте осушители
- Используйте покрытие или барьерный продукт, такой как жир, масло, краска или покрытие из углеродного волокна
- Укладка слоя обратной засыпки, например известняка, с подземным трубопроводом
- Использование расходуемого анода для обеспечения системы катодной защиты
Эти эффективные ингибиторы коррозии помогут продлить срок службы ваших активов.
Коррозионные услуги и экспертиза
TWI может предоставить экспертную помощь и знания в области предотвращения коррозии во всех отраслях промышленности.
Покрытие и проектирование поверхностей
TWI может посоветовать лучшие методы покрытия и материалы для ваших нужд из широкого спектра доступных вариантов.
Испытания на коррозию
Помещения TWI позволяют проводить крупномасштабные и мелкомасштабные испытания на коррозию в соответствии со стандартами и требованиями клиентов.
Что вызывает коррозию?
Что такое коррозия?
Коррозия – это естественный процесс, связанный с износом металлических компонентов. Согласно NACE International , коррозия — это «разрушение вещества (обычно металла) или его свойств из-за реакции с окружающей средой». В конечном итоге это может привести к серьезному повреждению вашего здания или приложения и может стать очень дорогостоящим ремонтом.
Как возникает коррозия
Коррозия — это электрохимическая реакция, которая проявляется в нескольких формах, таких как химическая коррозия и атмосферная коррозия, последняя из которых является наиболее распространенной формой. Когда кислотные вещества (включая воду) вступают в контакт с металлами, такими как железо и/или сталь, начинает образовываться ржавчина. Ржавчина является результатом коррозии стали после того, как частицы железа (Fe) подверглись воздействию кислорода и влаги (например, влажности, пара, погружения). Когда сталь подвергается воздействию воды, частицы железа теряются в кислых электролитах воды. Затем частицы железа окисляются, что приводит к образованию Fe⁺⁺. Когда образуется Fe⁺⁺, два электрона высвобождаются и текут через сталь к другой области стали, известной как катодная область.
Ржавчина является результатом коррозии стали после того, как частицы железа (Fe) подверглись воздействию кислорода и влаги (например, влажности, пара, погружения). Когда сталь подвергается воздействию воды, частицы железа теряются в кислых электролитах воды. Затем частицы железа окисляются, что приводит к образованию Fe⁺⁺. Когда образуется Fe⁺⁺, два электрона высвобождаются и текут через сталь к другой области стали, известной как катодная область.
Кислород заставляет эти электроны подниматься вверх и образовывать гидроксильные ионы (ОН). Ионы гидроксила реагируют с FE⁺⁺ с образованием водного оксида железа (FeOH), более известного как ржавчина. Там, где были пораженные частицы железа, теперь образовалась коррозионная ямка, а то место, где они сейчас находятся, называется продуктом коррозии (ржавчиной).
Коррозия может происходить с любой скоростью, в зависимости от среды, в которой находится металл. Однако, поскольку атмосферная коррозия широко распространена, рекомендуется принимать эффективные меры предосторожности, когда речь идет о предотвращении коррозии.
Удаление и обработка ржавчины
В зависимости от ситуации и применения вы можете обработать участок, подвергшийся коррозии. Если пораженный участок небольшой и поддается лечению, вам могут потребоваться некоторые инструменты и продукты для его удаления. Начните с удаления ржавчины с металла с помощью таких инструментов, как шлифовальный круг или игольчатый пистолет. Будьте осторожны, чтобы не нанести дополнительных повреждений металлу.
Для больших коррозионно-коррозионных участков может потребоваться постоянное защитное покрытие, такое как антикоррозионное защитное покрытие SI-COAT компании CSL. Вы также захотите потратить это время, чтобы посмотреть на приложение в целом на наличие других преждевременных признаков коррозии.
Как предотвратить коррозию?
Одним из лучших способов предотвращения коррозии является нанесение антикоррозионного защитного покрытия . Защитное покрытие защищает подложку, предотвращая контакт подложки с агрессивными средами (атмосферными, химическими и т. д.). Здесь, в CSL Silicones Inc, мы предлагаем два вида антикоррозионных защитных покрытий (один из них — экологически безопасный вариант с низким содержанием летучих органических соединений!), которые легко наносятся с помощью всего лишь одного слоя. Si-COAT® 579 Защитное покрытие AC экономично и обеспечивает длительную защиту практически любой поверхности.
Защитное покрытие защищает подложку, предотвращая контакт подложки с агрессивными средами (атмосферными, химическими и т. д.). Здесь, в CSL Silicones Inc, мы предлагаем два вида антикоррозионных защитных покрытий (один из них — экологически безопасный вариант с низким содержанием летучих органических соединений!), которые легко наносятся с помощью всего лишь одного слоя. Si-COAT® 579 Защитное покрытие AC экономично и обеспечивает длительную защиту практически любой поверхности.
Покрытия экологически безопасны, обладают превосходной термостойкостью (могут выдерживать температуры от -76°F до 392°F), не мелеют и не выгорают, имеют малослойную пленку, требуют нанесения только одного слоя и имеют превосходная стойкость к УФ-излучению. Эластичность 180% делает покрытие очень гибким, что допускает тепловое расширение и сжатие основания, на которое оно наносится.

|