/ Ответы на вопросы к Контрольной работе № 1 (первые 5 заданий) - 2006 год / Zad2. Лада пиррола
12.2. Пятичленные гетероциклические
соединения с одним гетероатомом
Наиболее важны в практическом отношении такие пятичленные гетероциклы, как пиррол, фуран, тиофен и конденсированные системы на их основе: индол, кумарон и карбазол.
пиррол фуран тиофен
индол кумарон карбазол
12.2.1. Номенклатура пиррола, фурана и тиофена и их производных
Пиррол, фуран и тиофен могут иметь систематические названия по номенклатуре гетероциклов азол, оксол и тиол соответственно или по заменительной номенклатуре 1-азациклопентадиен-2,4, 1-оксациклопентадиен-2,4, 1-тиациклопентадиен-2,4 соответственно. Но систематические названия практически не используются.
Положение заместителей указывается греческими буквами или цифровыми локантами:
Например:
2-бром-5-метилпиррол 2-фуранкарбальдегид 2,4-диметилтиофен
-бром-’-метилпиррол-фуранкарбальдегид,’-диметилтиофен
фурфурол
Радикалы, образованные от пиррола, фурана, тиофена и их производных, имеют следующие тривиальные названия:
-пиррил -пиррил-тиенил-тиенил
-фурил -фурил фурфурил
12.2.2. Строение пиррола, фурана и тиофена
Молекулы пиррола, фурана и тиофена содержат систему сопряжённых связей и атом с неподелённой электронной парой. В результате образуется циклическая сопряжённая система с шестью -электронами (четыре -электрона от двух двойных связей и два — от гетероатома). Поэтому можно считать, что эти соединения имеют ароматический характер.
За счёт неподелённой электронной пары гетероатом в этом кольце является электронодонором, поэтому на углеродных атомах электронная плотность повышена (по сравнению с бензолом) и пятичленные гетероциклы в целом являются -избыточными ароматическими системами. Циклическую делокализацию неподелённой пары электронов гетероатома можно показать с помощью граничных структур:
Квантово-химическими расчётами показано, что величина электронной плотности в -положении больше, чем в-положении.
В пространстве молекула такого соединения представляет плоский пятиугольник, однако длины связей и валентные углы неодинаковы. Это связано с неравномерностью распределения -электронной плотности в кольце и зависит от природы гетероатома. Чем электроотрицательнее гетероатом, тем более неравномерно распределена электронная плотность и, следовательно, меньшей ароматичностью обладает система. Поэтому ряд уменьшения ароматичности (по сравнению с бензолом) можно показать следующим образом (в скобках приведена энергия делокализации ароматической системы в кДж/моль):
бензол (151) > тиофен (122) > пиррол (90) > фуран (68).
12.2.3. Физические и химические свойства пиррола, фурана и тиофена
Пиррол, фуран и тиофен являются бесцветными жидкостями с приятным запахом, практически нерастворимы в воде.
Химические свойства пятичленных гетероциклических соединений определяются как наличием ароматического цикла, так и наличием гетероатома.
12.2.3.1. Кислотно-оснόвные свойства
Пиррол, фуран и тиофен взаимодействуют с сильными кислотами. В случае пиррола, фурана и их алкилпроизводных обычно происходит «осмоление» (олигомеризация и полимеризация), тиофеновое кольцо к разрушению под действием холодных кислот устойчиво. Данное свойство пиррола, фурана и отчасти тиофена и их производных называется ацидофобностью. Ацидофобность связана с присоединением протона в большинстве случаев к -углеродному атому, разрушением ароматической системы и дальнейшим превращением активной диеновой системы:
Наибольшей основностью обладает пиррол, он легче всего протонируется. Самым слабым основанием из рассматриваемых гетероциклов является тиофен, он наиболее трудно протонируется, поэтому он наименее ацидофобен.
Введение в молекулу электроноакцепторных заместителей уменьшает электронную плотность на ароматическом кольце и тем самым снижает ацидофобность. При наличии сильных электроноакцепторов в гетероциклическом кольце соединение может и вовсе быть устойчиво к действию кислот, как, например, молекула пирослизевой кислоты:
пирослизевая кислота
К действию оснований фуран и тиофен устойчивы, так как не содержат подвижных атомов водорода, а пиррол является слабой NH-кислотой (рКа = 17.5) и при сплавлении со щелочами образует соли:
пиррил-калий
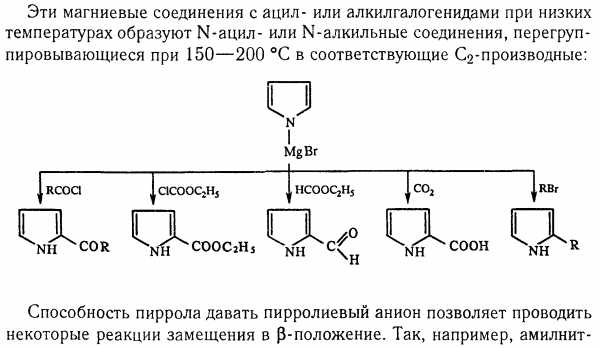
По кислотности пиррол сравним со спиртами, и поэтому для получения его солей могут использоваться также алкоголяты или металлорганические соединения, как, например, при взаимодействии с реактивом Гриньяра:
бромид N-пиррилмагния
Соли пиррола используются для алкилирования (и ацилирования) молекулы пиррола соответствующими алкилгалогенидами (или ацилгалогенидами). Реакция протекает по азоту или по -углеродному атому:
12.2.3.2. Реакции электрофильного замещения
В общем случае электрофильное замещение для пиррола, фурана и тиофена протекает легче, чем для бензола в связи с большей величиной -электронной плотности в молекуле гетероциклов. При этом на атомах углерода в наибольшей степени повышена электронная плотность в кольце пиррола по причине большего +М-эффекта атома азота по сравнению с другими гетероатомами. Поэтому реакционная способность по отношению к электрофилам будет увеличиваться в ряду: бензол < тиофен < фуран < пиррол.
Электрофильное замещение в пирроле, фуране и тиофене протекает селективно в -положение, но когда оно занято, то реакция идёт по -углеродному атому. Направление реакции в -положение объясняется сравнением устойчивости образующихся -комплексов (и подтверждается квантово-химическими расчётами):
Влияние заместителей в гетероциклическом кольце на направление электрофильного замещения проявляется только в том случае, если оба -положения заняты, либо оба -положения свободны, а заместитель находится в -положении. В этих случаях электрофильная атака протекает в соответствии с влиянием заместителей на распределение электронной плотности в данном ароматическом кольце. Например:
Для нитрования пиррола, фурана и тиофена азотная кислота не используется по причине ацидофобности этих соединений. Нитрование фурана и тиофена проводят ацетилнитратом Ch4COONO2, для чего используют раствор азотной кислоты в уксусном ангидриде:
,
хотя возможно использование и других смешанных ангидридов или эфиров азотной кислоты. При этом фуран первоначально образует продукт присоединения ввиду своего выраженного диенового характера, а затем отщепляет молекулу уксусной кислоты (обычно под действием органического основания) и превращается в продукт замещения:
2-нитрофуран
-Нитропиррол в отличие от нитропроизводных фурана и тиофена получают через соли пиррола. Например, при использовании этилнитрата:
2-нитропиррол
Сульфировать серной кислотой можно только тиофен:
тиофен-2-сульфокислота
(Механизм сульфирования здесь такой же, как и механизм взаимодействия с холодной концентрированной серной кислотой бензола и его производных.)
Для сульфирования пиррола и фурана по причине их ацидофобности используют комплексы триоксида серы с электронодонорами, обычно пиридинсульфотриоксид или диоксансульфотриоксид:
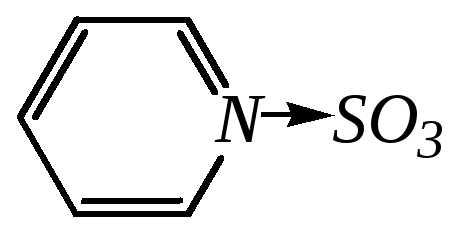
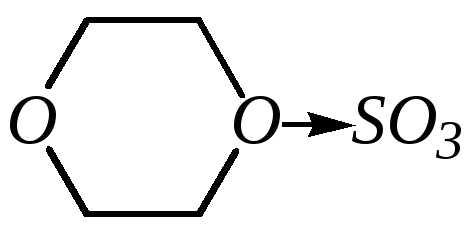
пиридинсульфотриоксид диоксансульфотриоксид
Механизм сульфирования такими комплексами аналогичен механизму сульфирования триоксидом серы:
Пиридин (или диоксан) в качестве донора электронной пары необходим для связывания отщепляющегося протона.
Галогенирование (хлорирование, бромирование, йодирование) пиррола и тиофена протекает настолько легко, что если специальным образом не контролировать течение реакции, образуются тетрагалогенопроизводные. Так, например, бромирование пиррола раствором брома в этаноле при 273 К даёт тетрабромпиррол:
Получение монобромпиррола (-изомер) представляет определённую трудность, и необходимо специальным образом контролировать течение реакции или использовать специальные бромирующие агенты. Для получения монобромтиофена применяют достаточно низкие температуры (248—268 К). Для хлорирования используют сульфурилхлорид SO2Cl2 или тетрахлорид олова SnCl4. Йодирование осуществляется молекулярным йодом (или KI + h3O2) в присутствии кислотного катализатора.
Галогенирование фурана протекает через реакцию присоединения (с последующим отщеплением галогеноводорода) — в этом проявляется диеновый характер этого гетероцикла. Здесь возможно хлорирование (газообразным хлором) или бромирование с образованием полигалогенопроизводных, но не йодирование. Фуран не реагирует с йодом.
Ацилирование пиррола, фурана и тиофена осуществляют ангидридами (реже галогенангидридами) карбоновых кислот.
Алкилирование фурана и пиррола не проводят, так как вероятные продукты этой реакции ещё более ацидофобны и полимеризуются за счёт выделяющегося галогеноводорода.
Высокая активность пиррола иллюстрируется его способностью реагировать со слабыми электрофилами, например с солями арендиазония, диоксидом углерода, альдегидами. Скорость азосочетания сильно зависит от рН среды. При значениях рН ниже 8 в реакцию сочетания с катионом бензолдиазония вступает нейтральная молекула пиррола, а при значениях рН раствора выше 10 в реакции участвует пиррил-анион, и она в этом случае протекает в 108 раз быстрее. В более щелочных условиях происходит образование 2,5-бис-диазопроизводных.
Взаимодействие пиррил-калия с диоксидом углерода протекает по механизму, аналогичному реакции Кольбе–Шмитта (гл. 10.5.3.3), с образованием пиррол-2-карбоновой кислоты.
12.2.3.3. Реакции присоединения
В этих реакциях проявляется диеновый характер гетероциклов. Поэтому такие реакции наиболее характерны для фурана. Примерами могут быть присоединение водорода, галогенов и реакция диенового синтеза.
Водород присоединяется в присутствии катализаторов (Ni, Pd, Pt) при нагревании и под давлением. Из пиррола, фурана и тиофена образуются соответствующие тетрагидропроизводные — пирролидин, тетрагидрофуран и тиофан:
(X = NR, O, S)
Труднее всех гидрируется тиофен и его производные, а легче — фуран.
Присоединение галогенов наиболее характерно для фурана, причём продукт присоединения может отщеплять молекулу галогеноводорода, давая продукт формального замещения, например:
2,5-дибром-2,5-дигидрофуран 2-бромфуран
Реакции диенового синтеза характерны, главным образом, для фурана. Это, например, взаимодействие с малеиновым ангидридом:
Тиофен с малеиновым ангидридом не реагирует, но он может быть введён в реакцию Дильса–Альдера при использовании очень реакционноспособных алкинов, например дицианоацетилена; но продукт присоединения легко теряет атом серы и превращается во фталодинитрил:
Пиррол взаимодействует с малеиновым ангидридом как с электрофилом:
12.2.3.4. Реакции замены гетероатома
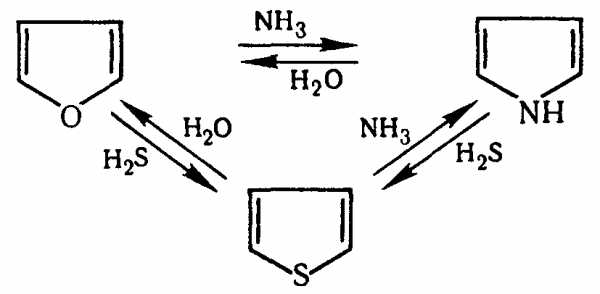
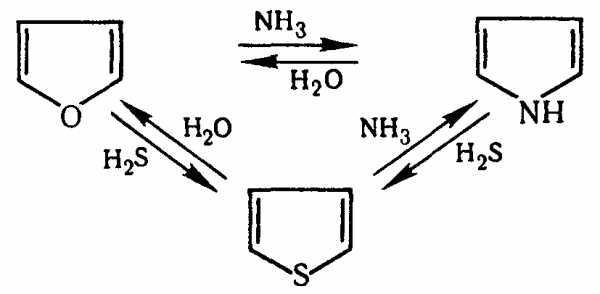
Эти реакции представляют взаимное превращение пиррола, фурана и тиофена:
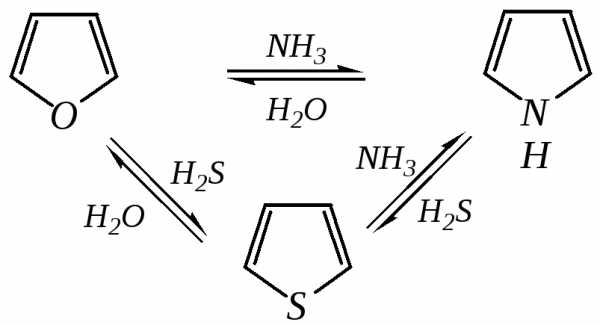
Они были открыты в 1936 году Ю.К. Юрьевым и называются также синтезом Юрьева или циклом Юрьева.
Реакции осуществляются при температуре 670—770 К в присутствии катализатора Al2O3. Практическое значение имеют только превращения фурана в пиррол и тиофен:
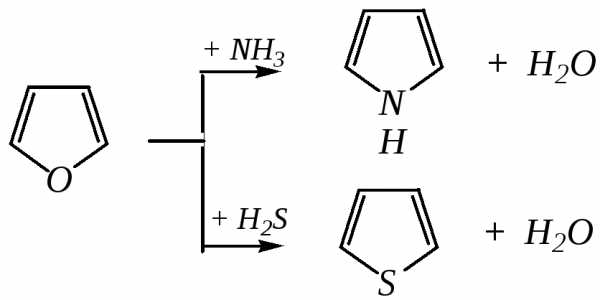
В остальных четырёх реакциях (с участием пиррола и тиофена) выход продуктов не превышает 2%.
Причиной предпочтительного участия фурана во взаимопревращениях в другие гетероциклы можно считать его меньшую ароматичность, а также наибольшую жёсткость атома кислорода как оснόвного центра (по Р. Пирсону) в сравнении с азотом и серой в пирроле и тиофене. Тогда механизм превращения фурана, например в тиофен, можно представить в следующем виде:
(2 HAlO2 Al2O3 + h3O)
studfiles.net
29. Пиррол. Получение, строение, химические свойства. Применение.
Тиофен – бесцветная жидкость с температурой кипения = 130 ºС, быстро темнеющий на воздухе в результате окисления.
Строение
Пиррол - 6-электронные-избыточные системы, образованные за счет электронов двойных связей и неподеленной пары электронов гетероатома, причем 6-электронов приходятся на пять атомов кольца, что существенно повышает электронную плотность на каждом кольцевом атоме. 6 р-электронов образуют единое электронное облако (как в бензоле).
Для каждого гетероцикла существуют следующие взаимопереходящие друг в друга структуры:
где Z=O,S,N
Получение
1) Дегидратационная циклизация 1,4-диоксосоединения. Промежуточным продуктом в синтезе пиррола является имин:
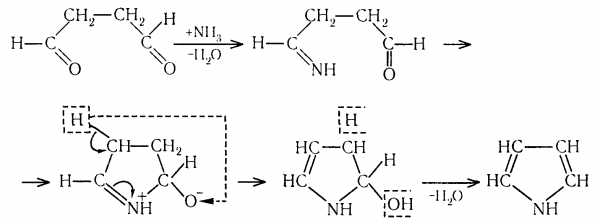
2) Перегонка имида янтарной кислоты с цинковой пылью:
3) Пропускание аммиака и паров 1,4-бутиндиола над смесью оксидов алюминия (95%) и тория (5%) при 300 ºС:
4) Получение гетероциклов реакцией Юрьева - взаимным превращением фурана, пиррола и тиофена друг в друга
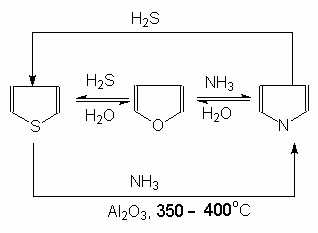
Химические свойства
1. Кислотно-основные превращения
1.1 Кипячение со спиртовым гидроксиламином превращает многие производные пиррола в диоксимы 1,4-дикетонов:
1.2 Пиррол является слабой кислотой и реагирует с калием и щелочами, образуя соль пиррола:
2. Реакции присоединения
2.1 При восстановлении пиррола цинком в уксусной кислоте образуется пирролин (2,5-дегидропиррол), а при гидрировании над платиной образуется пирролидин:
2.2 Диеновый синтез. Реакция Дильса-Альдера. Например, с малеиновым ангидрирод он образует ангидрид 2-пирил-янтарной кислоты:
2.3 Окисление
3. Реакции замещения
3.1 Галогенировапние
3.2 Нитрование
Для пиррола нитрование ведется в пиридине ацетилнитратом. Всегда начальный продукт - -нитропроизводное.
3.3 Сульфирование
Пиррол сульфируется – комплексом SO3с пиридином в пиридине. В первую очередь образуются-сульфокислоты, связанные с пиридином:
3.4. Ацилирование
Ацилирование пиррола осуществляют ангидридами кислот, при катализе хлористым цинком и оловом.
3.5. Реакции с хлорной ртутью.
Для всех пятичленных гетероциклов характерна реакция и хлоридом ртути с замещением водорода в -положение:
4. Расширение цикла

5. Реакции замены гетероатома.
Применение
Пиррол применяется для синтеза различных органических соединений, в том числе лекарственных средств. Производные пиррола имеют большое биологическое значение. К ним относятся такие вещества, как хлорофилл растений, гемин крови, пигменты желудка. Восстановленное кольцо пиррола присутствует во многих алкалоидах и аминокислотных белках.
В химии пиррола большую роль играет его способность замещать водород при атоме азота металлами с образованием пиррольного аниона. Различные реакции замещения в пиррольном ядре можно проводить, используя металлические производные в качестве промежуточных продуктов. Наиболее часто применяют пирролмагнийгалогениды, образующиеся при реакции пиррола с реагентами Гриньяра:
studfiles.net
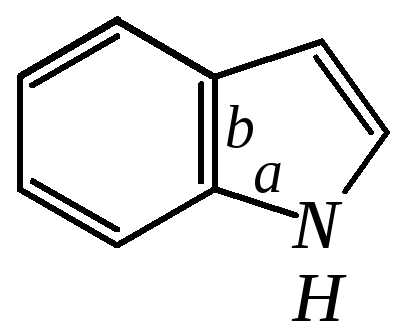
12.2.4. Особенности индола
Название индола как конденсированной системы, содержащей гетероциклическое кольцо пиррола, — бензо[b]пиррол.
Нумерацию атомов в индоле начинают с гетероатома, атомы углерода в пиррольном цикле могут быть обозначены также греческими буквами:
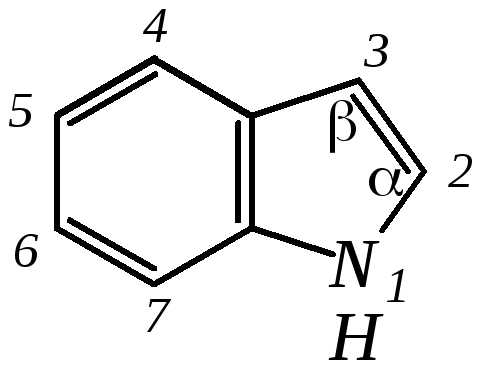
Индол и его производные — это бесцветные кристаллические вещества, не растворяющиеся в воде и имеющие своеобразный неприятный запах.
12.2.4.1. Строение
Молекула индола представляет 10--электронную бициклическую сопряжённую систему, в которой участвует гетероатом со своей неподелённой электронной парой. В результате электронодонорного мезомерного эффекта атома азота повышается электронная плотность в положениях 3, 5 и 7:
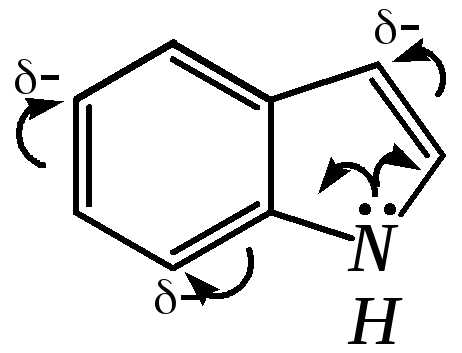
12.2.4.2. Кислотно-осόвные свойства
Сильные кислоты протонируют индол в положение 3, тем самым нарушается сопряжённая система пиррольного цикла, что приводит к его раскрытию и дальнейшим превращениям (димеризация, олигомеризация):
Индол является слабой NH-кислотой (по кислотности сравним с пирролом). Он образует соли при действии щелочей, алкоголятов и металлорганических соединений (аналогично пирролу).
12.2.4.3. Реакции с электрофилами
Ввиду выраженных ацидофобных свойств индола его реакции с сильными электрофилами в кислой среде приводят к продуктам олигомеризации. С более мягкими электрофилами осуществляется замещение в -положение. Если оно занято, то реакция протекает в -положение. Объяснить такое направление электрофильного замещения можно сравнением устойчивости образующихся -комплексов:
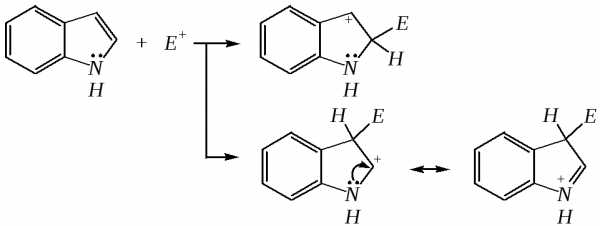
(Здесь не приведены граничные структуры с участием -электронной плотности бензольного кольца по причине их значительно меньшего вклада, но таких структур было бы в каждом случае на три больше.)
Как видно из приведённых направлений взаимодействия индола с электрофильной частицей, делокализация положительного заряда в случае атаки по -атому (второе направление) полнее и такой -комплекс устойчивее.
Нитрование индола осуществляется так же, как и пиррола, через образование солей, сульфирование — пиридинсульфотриоксидом, а для бромирования используется комплекс брома с диоксаном:
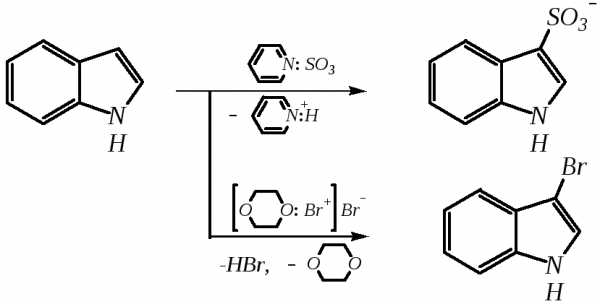
Алкилирование может осуществляться как по атому азота, так и по атому углерода. Направление реакции определяется главным образом температурой, а также природой металла и растворителем. Это можно изобразить схемой:
12.2.4.4. Реакции окисления
Мягкое окисление индола даёт синий краситель индиго:
индиго (синего цвета) соль белого индиго
Сильными окислителями (KMnO4) индиго окисляется до изатина:
изатин
12.2.5. Способы получения пиррола, фурана, тиофена, индола
В небольших количествах пиррол и тиофен содержатся в каменноугольной смоле. При этом тиофен выгоняется из неё вместе с бензолом.
К синтетическим способам получения можно отнести следующие.
Общим способом получения пиррола, фурана и тиофена и их производных является циклизация -дикарбонильных соединений. Механизм кислотно-катализируемого образования фуранов можно представить в следующем виде:
В синтезе пирролов необходима нуклеофильная атака аммиаком, а для получения тиофенов используются сульфиды фосфора. Например, механизм образования пирролов:
Для получения фурана и его производных используют природные моносахариды. При нагревании в присутствии минеральных кислот может образоваться фурфурол:
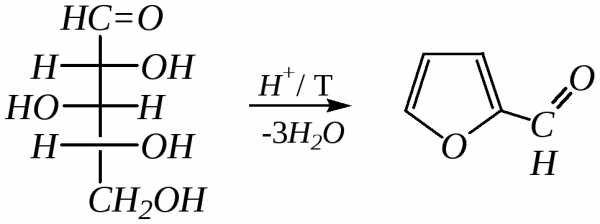
D-ксилоза фурфурол
или другие производные фурана в зависимости от природы исходного моносахарида (гл. 7.1.2.3).
При нагревании гликаровых (гл. 7.1.2.1) кислот образуется пирослизевая кислота:
пирослизевая кислота
Пиррол образуется при нагревании аммониевых солей гликаровых кислот:
Универсальным и удобным в практическом выполнении методом получения производных пиррола является взаимодействие -аминокетонов с кетонами, содержащими реакционноспособную метиленовую группу (синтез Кнорра*). Например:
Пиррол и тиофен могут быть получены из фурана с помощью реакций Юрьева (см. выше).
Для получения индола и его производных практическое значение имеет реакция Фишера, которая ещё называется синтезом индолов по Фишеру. Это метод получения производных индола из фенилгидразонов альдегидов или кетонов. Реакция протекает при нагревании арилгидразонов в присутствии таких катализаторов, как ZnCl2, разбавленная h3SO4, концентрированная Ch4COOH, спиртовый раствор HCl:
Общепринятый в настоящее время механизм этой реакции можно представить в следующем виде:
studfiles.net
3_Spetsialnye_Razdely
Все атомы углерода и атом азота находятся в состоянии sp2-гибридизации, и всеσ-связи(С—С и С—N) лежат водной плоскости. У атома азота из трех его гибридных орбиталей две образуютσ-связи с атомами углерода, а третья содержит неподеленную пару электронов. На негибридной р-орбитали, расположенной перпендикулярно плоскостиσ-скелета, находитсяодин электрон, благодаря которому атом азота участвует в образовании единого электронного облака с р-орбиталями пяти атомов углерода. Атом азота с такой электронной конфигурацией называют пиридиновым.
Таким образом, молекула пиридина отвечает критериям ароматичности, сформулированным для ароматических углеводородов, а именно имеет плоский σ-скелет, сопряженную замкнутую электронную систему, охватывающую все атомы цикла и содержащую шестьπ-электронов, удовлетворяя формуле Хюккеля (4п + 2 при п = 1). В этом отношениипиридин изоэлектронен бензолу.
В то же время имеет ряд отличий от бензола. Во-первых, его молекула не представляет собой правильный шестиугольник, так как связь С—Nкороче связей С—С и, как следствие, валентные углы отличаются. Во-вторых, пиридин обладает значительным дипольным моментом.
Пиридин и другие гетероциклы, содержащие атом азота пиридинового типа(хинолины, диазины), называютπ-дефицитными, илиπ-недостаточными, системами. Их отнесение кπ-дефицитным сделано на основе электроноакцепторных свойств гетероатома, что приводит к дефициту электронов на атомах углерода. Важной особенностьюπ-электронного распределения в пиридине является чередование частичных зарядов в кольце: атомы С-2 и С-6 (называемые также α-положениями), а также С-4 (γ-положение) имеют частичный положительный заряд, т. е. они наиболее электронодефицитны, тогда как атомы С-3 и С-5 (β-положения) заряжены слегка отрицательно.
Пятичленные гетероциклы с одним гетероатомом.
К ним относится пиррол, фуран и тиофен — представляют собой плоские пятиугольники с четырьмя атомами углерода и соответствующим гетероатомом — азотом, кислородом или серой — в состоянии sp2-гибридизации.
Пиррол, как и пиридин, содержит sр2-гибридизованный атом азота, но в иной конфигурации. На негибридной р-орбитали находится пара электронов, а гибридные орбитали содержат по одному электрону. Две гибридные орбитали образуют связи с атомами углерода, а третья участвует в образованииσ-связи с атомом водорода. Атом азота с рассмотренной конфигурацией называютпирольным. Пять негибридных орбиталей, перекрываясь, образуютединое шестиэлектронное облако, и пиррол, таким образом, удовлетворяет структурным критериям ароматичности.
В фуране и тиофене неподеленная пара электронов соответственно атомов кислорода и серы, находящаяся на негибридной р-орбитали, как и у пиррольного атома азота, включается в сопряжение с р-электронами атомов углерода с образованием ароматического секстета.
По своему электронному строению пиррол, фуран и тиофен изоэлектронны циклопентадиенид-иону, но в отличие от него молекулы гетероциклов не представляют собой правильные пятиугольники. Пиррол, фуран и тиофен относятся к π-избыточным гетероциклам, так как в них число электронов, образующих ароматическую систему, превышает общее число атомов в цикле (соотношение равно 6:5).
Конденсированные системы.
Хинолин и изохинолинпредставляют собой изомерныеконденсированные системы пиридина и бензола, различающиеся способом сочленения колец. Этим гетероциклам родственна конденсированная система пиридина и двух бензольных колец, называемаяакридином. Ряд синтетических производных всех трех гетероциклов применяется как лекарственные средства и красители. К природным производным хинолина и изохинолина относятся некоторые алкалоиды.
Хинолин и изохинолин, сочетающие в себе два ароматических цикла, также являются ароматическими системами: они удовлетворяют правилу Хюккеля (десять π-электронов в едином сопряжении) и остальнымструктурным критериям ароматичности. Будучи изоэлектронными нафталину, оба гетероцикла сочетают в себе химические свойства пиридина и нафталина. Эти свойства хинолина и изохинолина во многом сходны и поэтому рассматриваются в основном на примере хинолина как более распространенного гетероцикла.
Молекула пуринапредставляет собой конденсированную системупиримидина и имидазола. По всем критериям пуринотносится к ароматическим соединениям. Его сопряженная система включает 10 р-электронов — по одному от атомов углерода и трех атомов азотапиридинового типа(N-1,N-3 иN-7 илиN-9, в зависимости от таутомерной формы) и два электрона атома азотапиррольного типа. Молекула пурина в целом представляет собой высокоπ-недостаточнуюсистему, хотя имидазольное кольцо обладает небольшой π-избыточностью:
Представители.
Пиррол - наибольшее распространение в растительном и животном мире имеют производные пиррола, являющиеся структурными фрагментами гема и хлорофиллов, пигментов желчи, ряда антибиотиков и алкалоидов. Пиррол умеренно токсичен, его пары вызывают стойкое и упорное повышение температуры тела.
Индол служит исходным сырьём для синтеза гетероауксина,триптофана, используется в парфюмерной и фармацевтической промышленности. Многиеалкалоидысодержат ядро индола.
Имидазол — структурный фрагмент витамина В12, некоторый алкалоидов, белковой аминокислоты гистидина и ее метаболита — биогенного амина гистамина, а также некоторый лекарственный средств. Вместе с шестичленным гетероциклом пиримидином он образует конденсированную гетероциклическую систему пурина.
Оксазол используется в фотографии, как флуоресцентный отбеливатель, антиоксидант. Многие оксазолы входят в состав ЛС, обладающих анальгезирующим, жаропонижающим, антибиотическим действием.
Пиримидин. Ядро пиримидина входит в состав нуклеиновых кислот, витаминов (B1), антибиотиков (амицетин, блеомицин), ЛС (барбитураты, пиримидиновые сульфамиды), сильных ядов, коэнзимов и др.
Пурин. Производные, содержащие систему пурина, широко распространены в природе и играют большую роль во многих биологических. биол. процессах. Важнейшие производные пурина - аденин, гуанин (пуриновые основания), гипоксантин, кофеин (пуриновые алкалоиды), мочевая кислота.
Ядро пурина входит в состав некоторых антибиотиков и нуклеотидов, являющихся структурными фрагментами нуклеиновых кислот. Пурин и ряд его производных обладают противоопухолевой, противовирусной и противоаллергической активностью.
Пятичленные гетероциклы с одним гетероатомом: электронное строение, ацидофобность; кислотно–основные свойства пиррола; реакции электрофильного замещения, ориентация замещения, особенности нитрования, сульфирования, бромирования ацидофобных гетероциклов. Представители: пиррол, тиофен, фуран, пирролидин, тетрагидрофуран.
Поскольку пиррол, фуран и тиофен имеют сходное электронное строение, в их химическом поведении имеется много общего.
Реакции электрофильного замещения.
Как π-избыточные соединения, эти гетероциклы легко вступают в реакции с электрофильными реагентами. В незамещенных гетероциклах электрофильная атака осуществляется преимущественно по атому C-2 (α-положение), так как в промежуточно образующемся катионе (σ-комплексе) резонансная стабилизация эффективнее, чем в катионе при атаке β-положения.
π-Избыточность пятичленных гетероциклов накладывает определенные ограничения на условия проведения реакций с электрофильными реагентами, которые обычно осуществляются в кислой среде. В результате они подвергаются полимеризации, а в водных средах происходит разрыв гетероцикла. (!) Свойство соединений подвергаться глубоким превращениям под действием кислот называютацидофобностью, а сами гетероциклы —ацидофобными. Тиофен устойчив к действию сильных кислот и не относится к ацидофобным гетероциклам.
Многие реакции электрофильного замещения для пиррола и фурана требуют специальных условий, исключающих воздействие сильных кислот. Так, для сульфированияиспользуется пиридинсульфотриоксид, часто обозначаемый С5Н5N•SO3.Бромированиеосуществляют действием диоксандибромида С4н8О2•Вг2. В этом случае замещающийся протон связывается диоксаном, что предотвращает разрушающее действие сильных кислот. Для введениянитрогруппыв используют ацетилнитрат — смешанный ангидрид уксусной и азотной кислот.
Замещенные пятичленные гетероциклы также вступают в реакции электрофильного замещения, и влияние заместителей на легкость замещения принципиально не отличается от аналогичных реакций карбоциклических соединений, т. е. электронодонорные заместители облегчают реакцию, а электроноакцепторные — замедляют ее.
Сульфирование. Пиррол избирательно сульфируется пиридинсульфотриоксидом в α-положение, а если оба α-положения заняты, то атакуется β-атом углерода.
Нитрование. При низких температурах пиррол очень легко нитруется ацетилнитратом.
Галогенирование. Пиррол настолько легко подвергается галогенированию, что без соблюдения специальный условий образуются стабильные тетразамещенные продукты.
Кислотные и основные свойства
Пиррол является слабой NH-кислотойи образует соли только со щелочными металлами или с такими сильными основаниями, как гидриды или амиды щелочных металлов, а также при сплавлении с твердым гидроксидом калия (но не натрия). Образующиеся соли легко гидролизуются водой.
Основность пиррола чрезвычайно низка, и значение рКBH+характеризует основностьπ-системы гетероцикла, ане атома азота.
Представители.
Тиофен. Соединения ряда тиофена — это реагенты для разделения элементов, оптические отбеливатели, физиологически активные соединения. Многие производные — ЛС (антигельминтный препарат комбантрин, модифицированные антибиотики цефалотин, цефалоридин), мономеры для получения электропроводящих полимеров.
Фуран применяют для получения ТГФ, тиофена, пиррола, селенофена и малеинового ангидрида, а также в качестве растворителя и экстрагента масел и жиров. Производные фурана используют как ЛС (фурадонин, фуросемид) и средства защиты растений.
Пирролидин обнаружен в табаке и моркови, пирролидиновая структура входит в состав некоторых алкалоидов (никотина) и аминокислот пролина и гидроксипролина. Пирролидиновая структура входит в состав ЛС (пирацетама).
Тетрагидрофуран — это растворитель многих соединений; сырье для получения синтетических смол. Это структурный фрагмент некоторых антибиотиков (нактинов, с помощью которых осуществляется транспорт ионов К+ через клеточные мембраны.
Пятичленные гетероциклы с двумя гетероатомами: электронное строение; кислотно–основные свойства, образование ассоциатов; реакции электрофильного замещения в пиразоле и имидазоле. Представители: пиразол, имидазол, тиазол, оксазол.
Группу пятичленныгх гетероциклов, которые формально образованы из пиррола, фурана и тиофена путем замены звена —CH= хотя бы одним пиридиновым атомом азота, называют азолами. Частный случай представляют циклы с двумя атомами азота — диазолы. Азолы, содержащие два гетероатома, в зависимости от их взаимного расположения подразделяются на 1,2-азолы и 1,3-азолы. Наиболее значимыми из них являются имидазол, пиразол и тиазол.
Ароматичность.
Азолы можно рассматривать как аза-аналоги пиррола, фурана и тиофена, в который звено — CH= (атом C-2 или C-3) заменено фрагментом — N=, т. е. пиридиновым атомом азота.
Азолы относятся к 6π-электронным ароматическим соединениям. Так, в пиразоле и имидазоле один из атомов азота (N-1) принадлежит к пиррольному типу, а другой — к пиридиновому. Пиррольный атом азота вносит в сопряженную систему два р-электрона, а пиридиновый — один р-электрон (пары электронов гетероатомов, участвующие в сопряжении, показаны цветом). В оксазоле и тиазоле атомы азота принадлежат к пиридиновому типу, а атомы кислорода и серы имеют конфигурацию, подобную пиррольному атому азота. Все четыре гетероцикла изоэлектронны и в сопряжении принимают участие по шесть электронов, т. е. они соответствуют правилу Хюккеля.
Кислотные и основные свойства.
Азолы обладают основностью благодаря пиридиновому атому азота. Имидазол сильнее пиридина.
Остальные азолы значительно менее основны имидизола, вследствие сильного электроноакцепторного индуктивного влияния гетероатома в положении 1; особенно это заметно у 1,2-азолов.
Кислотные свойства присущи только диазолам — имидазолу и пиразолу, благодаря их NH-кислотному центру. Оба гетероцикла заметно превышают по кислотности пиррол. Причина этого заключается в лучшей делокализации отрицательного заряда в сопряженном основании с участием обоих атомов азота, как показано на примере имидазолат-иона:
Имидазол и пиразол проявляют амфотерный характер. В кристаллическом состоянии и в неполярных растворителях они образуют межмолекулярные ассоциаты. Ассоциаты имидазола содержат до 20 молекул, а пиразол существует в виде димеров и тримеров:
Неожиданно высокие температуры кипения диазолов по сравнению с оксазолом и тиазолом свидетельствуют о прочных межмолекулярных водородных связях. Диазолы, замещенные по атому N-1 (но не С-производные), не способны образовывать водородные связи и имеют значительно более низкие температуры кипения.
Реакции электрофильного замещения.
Реакционная способность азолов по отношению к электрофильным реагентам определяется π-балансом системы. Для этих гетероциклов общая π-избыточность или π-дефицитность зависит от того, какой из гетероатомов — пиррольного или пиридинового типа — оказывает большее влияние. Например, имидазол, пиразол и тиазол, для которых ниже показаны заряды на атомах цикла, относятся к слабо π-избыточным системам. В то же время оксазолу присуща незначительная π-дефицитность, вызванная электроотрицательностью атома кислорода.
Реакционную способность молекулы будет определять общая (невысокая) π-избыточность. Из-за присутствия в цикле электроноакцепторного атома азота пиридинового типа азолы вступают в реакции электрофильного замещения намного труднее, чем их аналоги с одним гетероатомом (пиррол, фуран и тиофен), но легче, чем пиридин. Замещение в 1,3-азолах идет преимущественно по атому С-5, в 1,2-азолах — по атому С-4.
Имидазол.
Алкилирование и ацилирование по атому азота. При нагревании с алкилирующими агентами (алкилгалогенидами или алкилсульфатами) 1-алкилимидазолы получаются с невысоким выходом, так как побочно образуются имидазолиевые соли.
Действие на имидазол галогенангидридов или ангидридов кислот приводит к высокореакционноспособным N-ацильным производным.
Восстановлением N-ацилимидазолов с высоким выходом могут быть получены альдегиды, а реакцией с магнийорганическими соединениями — кетоны:
Замещение по атомам углерода.
Нитрование и сульфирование.
Со слабыми электрофилами в кислой среде реакции не идут вовсе. До сих пор неизвестны примеры реакций алкилирования и ацилирования имидазола по Фриделю-Крафтсу.
В щелочной среде имидазолы со свободной NH-группой и хотя бы одним незамещенным кольцевым атомом углерода вступают в реакцию азосочетания:
С диазотированной сульфаниловой кислотой, например, образуются продукты, окрашенные в цвета от желтого до красного, обнаружить которые можно в количестве микрограммов. Это — давно известный тест Паули на имидазолы (качественная реакция).
Галогенирование имидазола в нейтральной среде, когда молекула не ионизирована, очень легко.
Пиразол.
Имеет много общего с имидазолом. Это касается как алкилирования и ацилирования по пиридиновому атому азота, так и электрофильного замещения. Отличие в реакциях электрофильного замещения заключается в направлении электрофильной атаки: в пиразоле она идет, как правило, по атому C-4, где π-электронная плотность максимальна. Если атом C-4 замещен, то электрофильная атака часто становится невозможной.
Подобно имидазолу, пиразол не алкилируется и не ацилируется по Фриделю-Крафтсу, но в отличие от имидазола он не вступает и в реакцию азосочетания.
Представители.
Пиразол и его производные в природе не обнаружены, но они используются в производстве лекарственных средств (анальгин, амидопирин, антипирин) и пестицидов.
Тиазол. Важнейшее соединение ряда тиазол — тиамин (Vit В1). Многие производные — лекарственные препараты (норсульфазол, фталазол). Тиазолидиновое кольцо — структурный фрагмент пенициллина и разнообразных полусинтетических пенициллинов.
Производные пятичленных азотсодержащих ароматических гетероциклов: пиразолон и его таутомерия, лекарственные средства на основе пиразолона–3; гистидин, гистамин, бензимидазол, дибазол.
Пиразолоны. Среди производных пиразола важное место занимают 5-гидроксипиразолы. Они существуют в нескольких таутомерных формах; три наиболее устойчивые ниже. В неполярных растворителях преобладает Ch3-таутомер с некоторым количествомNH-формы; эти формы имеют название пиразолоны. В водной среде основным являетсяNH-таутомер (с примесьюOH-формы).
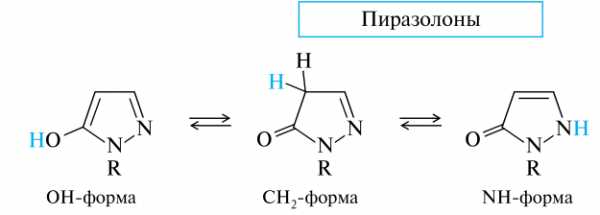
В медицине применяется ряд лекарственных средств, в основе которых лежит структура пиразолона-3. Наиболее известные из них — анальгин и диоксоаналог бутадион, обладающие противовоспалительным действием. Одним из первых синтетических анальгетиков, известным с 1884 г., был антипирин.
Имидазол — структурный фрагмент витамина белковой аминокислоты гистидинаи ее метаболита — биогенного аминагистамина, а также некоторый лекарственный средств.
Дибазол – лекарственный препарат группы периферических вазодилататоров. Препарат оказывает выраженное сосудорасширяющее действие, способствует снижению давления, обладает спазмолитическим эффектом.
Шестичленные гетероциклы: электронное строение; основные и нуклеофильные свойства пиридина и пиримидина, лактим–лактамная таутомерия гидроксипроизводных пиридина. Представители: пиридин, хинолин, изохинолин, пиримидин.
Основные свойства пиридина.
Неподеленная пара электронов атома азота в пиридине находится на sp2-гибридной орбитали и не участвует в сопряжении, поэтому пиридин проявляет основные свойства и с сильными кислотами образует кристаллическиепиридиниевые соли.
Соли пиридиния сохраняют ароматический характер, так как протонирование осуществляется за счет неподеленной пары электронов, не участвующей в образовании ароматического секстета. Для замещенных пиридинов в основном соблюдаются общие закономерности: электронодонорные заместители увеличивают основность, а электроноакцепторные понижают ее.
Нуклеофильные свойства пиридина:
Пиридиновый атом азотаспособен взаимодействовать и со многими электрофильными реагентами, проявляя тем самым и нуклеофильные свойства.
Реакции с электрофильными реагентами. В молекуле пиридина имеется два реакционных центра, способных принимать атаку электрофильными реагентами:
• атом азота с неподеленной парой электронов;
• π-электронная система ароматического кольца.
Присоединение к атому азота. Помимо протона, атом азота может присоединять и другие электрофильные частицы, превращаясь в катион пиридиния.
Алкилирование. Получаемые при этомN-алкилпиридиниевые соли сохраняют ароматическим характер, так как в результате реакции ароматическим секстет электронов не нарушается.
Ацилирование. ОбразуютсяN-ацилпиридиниевые соли (они гидролизуются влагой воздуха).
Сульфирование. Образуется пиридиний-1-сульфонат, более известный под названием пиридинсульфотриоксид - весьма реакционноспособное соединение, гидролизующееся горячей водой.
Нитрование. Образующееся при этомN-нитропроизводное применяется в качестве мягкого нитрующего реагента некислотного характера, как показано на примере нитрования бензола:
Замещение по атомам углерода. Хотя электрофильные реагенты атакуют в первую очередь нуклеофильный атом азота, такие реакции часто обратимы и даже в кислых средах присутствует небольшое количество свободного основания. Поэтому реакции электрофильного замещения в ряду пиридина возможны, но протекают в жестких условиях и настолько затруднены, что некоторые из известных реакций этого типа вовсе не идут с пиридинами.
Предпочтительная атака электрофилом β-положения объясняется не только распределением электронной плотности в статическом состоянии, но и большей стабильностью образующегося приβ-атакеα-комплекса.
Нитрование. Пиридин нитруется в ядро в очень жестких условиях.
Сульфирование. Пиридин очень устойчив к действию концентрированной серной кислоты и олеума. Сульфирование протекает значительно легче в присутствии каталитических количеств солей ртути(П) или хлорида алюминия.
Галогенирование. Бромирование пиридина успешно осуществляется в присутствии олеума.
Азины. Ненасыщенные шестичленные гетероциклы, содержащие один или более атомов азота, называются азинами. Представители с двумя атомами азота классифицируются как диазины. Изомерные диазины — пиридазин, пиримидин и пиразин — представляют собой устойчивые соединения, однако в свободном виде они в природе не встречаются.
Диазины содержат по два атома азота пиридинового типа и обладают основными свойствами. Однако основность диазинов значительно ниже, чем пиридина, поскольку второй атом азота выступает в роли электроноакцептора по отношению к первому. Протонирование диазинов осуществляется только в очень сильных кислотах, и соли образуются с участием лишь одного атома азота.
Нуклеофильный характердиазинов проявляется в реакции салкилгалогенидами, которая приводит к образованию четвертичных солей (здесь и далее в качестве примеров использован пиримидин — наиболее значимый и изученный из диазинов). Диазины вступают в эту реакцию труднее, чем пиридин.
Вследствие электроноакцепторного характера атомов азота понижена реакционная способность диазинов и в реакциях электрофильного замещения. Незамещенные диазины еще менее активны, чем пиридин, и не подвергаются сульфированию, нитрованию и многим другим реакциям замещения. Известны лишь некоторые реакциигалогенирования. Так, бромирование пиримидина приводит к замещению положения 5, которое равноценно β-положению в ядре пиридина и дезактивировано в меньшей степени, чем положения 2, 4 или 6.
studfiles.net
/ Ответы на вопросы к Контрольной работе № 1 (первые 5 заданий) - 2006 год / Zad2
2.Докажите соответствие критериям ароматичности молекул следующих соединений: толуола, фенола, анилина, бензальдегида, бензойной кислоты, пиррола, фурана, тиофена, пиразола, имидазола, пиридина, пурина.
Алгоритм ответа:
- какой вид сопряжения осуществляется в молекуле?
- донорное или акцепторное влияние оказывают заместители или гетероатомы на ароматический цикл?
- для азотсодержащих гетероциклических соединений изобразите электронное строение гетероатомов.
- активизируют или дезактивируют заместители или гетероатомы ароматический цикл по отношению к реакциям электрофильного замещения.
- выделите в молекуле кислотные или основные центры. В какой роли - п- или -П- основания вступают гетероциклические соединения (пиррол, фуран, тиофен, имидазол, пиридин, пиримидин) во взаимодействие с протонсодержащими кислотами?
Решение.
Толуол
π-Сопряжение в бензольнм кольце, приводяцее к возникновению ароматической системы.
Метильная группа обладает донорным действием на ароматический цикл, обладает +I-эффектом поэтому активизирует ароматический цикл по отношению к реакциям электрофильного замещения. Алкильные группы не могут участвовать в общем сопряжении, но они проявляют +I-эффект, действие которого в наибольшей степени испытывает π-электронная плотность.
Кислотный центр в толуоле – это метильная группа, за счет –I-эффекта бензольного ядра, может проявлять очень слабую(pKa=41) CH-кислотность.
Фенол
p,π-Сопряжение неподеленной пары электронов атома кислорода гидроксильной группы с π-электронами бензольного кольца.
в фенолах гидроксильная группа, помимо отрицательного индуктивного эффекта, обладает положительным мезомерным эффектом.
гидроксильная группа обладает сильным донорным действием на ароматический цикл благодаря сильному +М-эффекту, поэтому активизирует ароматический цикл по отношению к реакциям электрофильного замещения. +М > –I
Частичное смещение электронной плотности атома кислорода в сторону бензольного кольца приводит к повышению полярности связи О — H и, следовательно, увеличению подвижности атома водорода гидроксильной группы.
Большая подвижность атома водорода гидроксильной группы фенолов по сравнению со спиртами предопределяет и их большую кислотность. Участие же неподеленной пары электронов атома кислорода гидроксильной группы фенолов в сопряжении с π-электронами бензольного кольца понижает способность атома кислорода принимать протон и уменьшает основность фенолов. Следовательно, для фенолов характерно проявление кислотных свойств и не характерно проявление основных свойств. Доказательством большей кислотности фенолов по сравнению со спиртами является то, что фенол и его производные реагируют с водными растворами щелочей, образуя соли, называемые феноксидами. Феноксиды сравнительно устойчивы и, в отличие от алкоголятов, могут существовать в водных щелочных растворах. Однако при пропускании через такой раствор тока диоксида углерода феноксиды превращаются в свободные фенолы. Эта реакция доказывает, что фенол является более слабой кислотой, чем угольная кислота.
Анилин
p,π-Сопряжение неподеленной пары электронов атома азота амино группы с π-электронами бензольного кольца.
амино группа обладает сильным донорным действием на ароматический цикл благодаря сильному +М-эффекту, поэтому активизирует ароматический цикл по отношению к реакциям электрофильного замещения.
Амины, как и аммиак, проявляют ярко выраженные свойства оснований, что обусловлено наличием в молекуле амина атома азота, имеющего неподеленную пару электронов. Алифатические амины всегда более сильные основания, чем ароматические.
В ароматических аминах аминогруппа находится в р,π-сопряжении с π-электронами бензольного кольца. Неподеленная пара электронов атома азота, участвуя в сопряжении, становится менее склонной к образованию ковалентной связи с протоном. Помимо этого, плохая сольватируемость ароматических соединений в протонных растворителях и большой объем ароматического радикала также не способствуют протонированию атома азота ароматических аминов. Поэтому ароматические амины являются более слабыми основаниями.
Бензальдегид
В ароматических альдегидах и кетонах карбонильная группа находится в сопряжении с бензольным кольцом, проявляя – I-и – М-эффекты. Она оттягивает на себя электронную плотность бензольного кольца, что приводит к понижению величины δ+ на атоме углерода карбонильной группы. Этим объясняется более низкая реакционная способность ароматических оксосоединений по сравнению с алифатическими.
Карбонильная группа является электроноакцептором и дезактивирует ароматический цикл по отношению к реакциям электрофильного замещения.
Благодаря неподеленной электронной паре на атоме кислорода карбонильные соединения обладают слабыми основными свойствами и реагируют с кислотами.
Бензойная кислота
Карбоксильная группа находится в сопряжении с бензольным кольцом, проявляя – I-и – М-эффекты.
Карбоксильная группа является электроноакцептором и дезактивирует ароматический цикл по отношению к реакциям электрофильного замещения.
Карбоксильная группа за счет – I- и – М-эффектов понижает электронную плотность бензольного кольца и тем самым оказывает дезактивирующее действие, которое выражается в затруднении реакций электрофильного замещения в бензольном ядре. Карбоксильная группа как ориентант II рода направляет вновь вступающие группировки преимущественно в мета-положение, например, при нитровании бензойной кислоты.
Бензойная кислота, за счет сопряжения в самой карбонильной группе является OH-кислотой.
Гетероциклические соединения
Степень их ароматичности ниже, чем у классического ароматического соединения — бензола. Это связано с электроотрицательностью гетероатомов в рассматриваемых гетероциклах, в результате чего не может быть полного выравнивания электронной/ плотности по всем атомам цикла, как это характерно для бензола.
Вследствие повышенной электронной плотности в кольце (шесть р-электронов приходятся на пять атомов) пиррол, фуран и тиофен называют «π-избыточными» системами. В таких системах электронная плотность на атомах углерода несколько выше, чем в бензоле, и в основном сосредоточена на α-атомах углерода (положения 2 и 5).
Повышенная электронная плотность на атомах углерода приводит к тому, что эти гетероциклические соединения легко вступают в реакции электрофильного замещения.
Пиррол
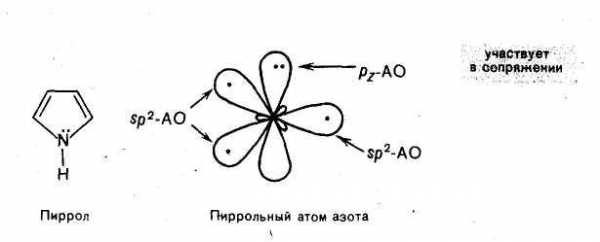
Пиррол — пятичленный гетероцикл с одним атомом азота — также относится к ароматическим соединениям. Атомы углерода и азота в нем, как и в пиридине, находятся в состоянии sр2-гибридизации. Но в отличие от пиридина, атом азота в природе имеет иную электронную конфигурацию. На негибриднойp-орбитали атома азота в пирроле находится неподеленная пара электронов. Она принимает участие в сопряжении с р-электронами четырех атомов углерода с образованием единого шестиэлектронного облака. Триsр2-гибридные орбитали образуют три σ-связи. Атом азота с рассмотренным электронным строением называютпиррольным.
Пиррольный атом азота, связанный с атомом водорода, может служить центром кислотности. Пиррол ведет себя как слабая NH-кислота.
Фуран
В других пятичленных гетероциклах с одним гетероатомом-фуране —неподеленная пара электронов атомов кислорода, так же, как и пиррольного атома азота, включается в сопряжение с р-электронами атомов углерода с образованием единого электронного облака, по числу электронов отвечающей правилу Хюккеля.
Не проявляют основных свойств пиррол, фуран и тиофен, у которых неподеленные пары электронов гетероатомов включены в общее электронное облако.
Тиофен
В тиофене —неподеленная пара электронов серы, так же, как и пиррольного атома азота, включается в сопряжение с р-электронами атомов углерода с образованием единого электронного облака, по числу электронов отвечающей правилу Хюккеля.
Пиразол
Примерами ароматических гетероциклов с двумя гетероатомами являются имидазол, пиразол и пиримидин. В имидазоле и пиразоле один из атомов азота относится к пиррольному типу, а другой — к пиридиновому. Пиррольный атом азота вносит в сопряженную систему два р-электрона, а пиридиновый — один p-электрон. В пиримидине оба атома азота являются пиридиновыми и предоставляют по одному р-электрону в сопряжение с р-электронами четырех атомов углерода.
Пиразол образуют соли с минеральными кислотами, благодаря пиридиновому атому азота.
Имидазол и пиразол, содержащие атомы азота пиридинового и пиррольного типов, одновременно проявляют как основные, так и кислотные свойства, т. е. являются амфотерными соединениями.
Имидазол
Имидазол и пиразол, содержащие атомы азота пиридинового и пиррольного типов, одновременно проявляют как основные, так и кислотные свойства, т. е. являются амфотерными соединениями.
Имидазол и пиразол образуют соли с минеральными кислотами, благодаря пиридиновому атому азота.
Однако пиррольный атом азота в имидазоле и пиразоле не атакуется протоном кислоты. Это объясняется тем, что неподеленная пара электронов пиррольного атома азота находится на негибридной р-орбитали и участвует в сопряжении, поэтому пиррольный атом азота не склонен присоединять протон, т. е. не является центром основности.
Пиридин
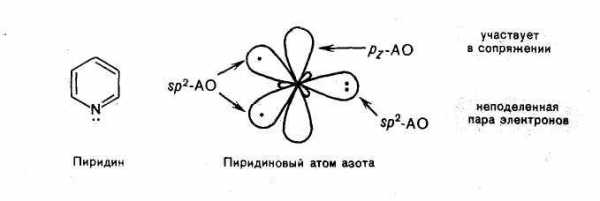
Пиридин — шестичленный гетероцикл с одним атомом азота — по своему электронному строению напоминает бензол. Все атомы углерода и атом азота находятся в состоянии sр2-гибридизации, и все σ-связи (C–C C–N и С–H) лежат в одной плоскости. Остановимся подробнее на электронном строении атома азота. Из трех его гибридных орбиталей две вступают в образование σ-связей с двумя атомами углерода, а третья орбиталь содержит неподеленную пару электронов; За счет электрона, находящегося на негибридной р-орбитали, атом азота участвует в образовании единого электронного облака с р-электронами пяти атомов углерода. Атом азота с таким электронным строением называют пиридиновым.
Таким образом, пиридин удовлетворяет критериям ароматичности — имеет плоский цикл, сопряженную электронную систему, охватывающую все атомы цикла и содержащую 6 р-электронов согласно правилу Хюккеля (4n+ 2 приn=1).
Основные свойства гетероциклических соединений обусловлены наличием гетероатома с неподеленной парой электронов, способной присоединять протон. Таким свойством обладает пиридиновый атом азота, у которого неподеленная пара электронов находится на sp2-гибридной орбитали и не вступает в сопряжение. Поэтому пиридин является основанием и с сильными кислотами образует соли.
В сравнении с бензолом электронная плотность в кольце пиридина распределена менее равномерно из-за большей электроотрицательности атома азота, чем углерода. Пиридин является «π-недостаточной системой» и трудно вступает в реакции электрофильного замещения
Пурин
Важнейшая конденсированная гетероциклическая система пурин состоит из двух сочлененных колец — имидазола и пиримидина. Пурин относится к ароматическим соединениям, он имеет плоский σ-скелет, его сопряженная система состоит из 10 р-электронов, включая неподеленную пару электронов атома N-7, что соответствует формуле Хюккеля (4n+ 2 при п =2). Пурин амфотерен благодаря имидазольному циклу и образует соли с сильными кислотами —за счет пиридиновых атомов азота и с основаниями — за счет NH-кислотного центра.
studfiles.net
Пиридин, пиррол-гетероциклические азотсодержащие органические вещества
Разделы: Химия
Тема урока: Пиридин пиррол – гетероциклические азотсодержащие органические вещества.
Цели урока:
- Дать понятие об азотсодержащих гетероциклах на примере пиридина и пиррола.
- Показать взаимозависимость строения со свойствами на примере пиридина и пиррола.
Оборудование: плакаты с формулами пиридина и пиррола.
Тип урока: информационная лекция.
Ход урока
Гетероциклические соединения представляют собой обширную и чрезвычайную важную группу органических веществ. Наиболее распространенными и важными из них являются азот- , кислород -, и серосодержащие гетероциклы.
Предлагается схема классификации (запись на доске)
(Учащиеся комментируют схему классификации органических циклических соединений, в том числе и гетероциклических.)
Учитель ограничивает необъятную область органической химии азотсодержащими гетероциклами и предлагает рассмотреть пиррол и пиридин, в результате – конспект.
| Название | Пиррол | Пиридин |
| Формула | C4H5N, C4h5NH | C5H5N |
| Значение | Пиррольные ядра входят в состав порфина – соединения, лежащего в основе гемоглабина и хролофилла. | Производные пиридина широко распространены в природе и играют важную роль в функционировании живых организмов. Ядро этого гетероцикла создается в витамине В1, некоторых антибиотиках, пиримидинованых основаниях. |
| Строение |
1) SP2 – гибридизация у атомов углерода. 2) образуется ароматическое кольцо. 3) атом водорода азота подвижен и способен замещаться. |
1) SP2 – гибридизация у атомов углерода. 2) образуется ароматическое кольцо. 3) На атоме азота – неподеленная электронная пара. |
| Вывод:
Химические свойства |
пиррол – кислота ароматического
характера. I. Как кислота 2C4h5NH+2K —> 2C4h5NK+h3 пиррол карий II. Как ароматическое соединение: а) замещение C4h5NH+4I2 —>C4I4NH++4 HI тетроиод пиррол б) присоединение C4h5NH+h3 —> пирролидин |
пиридин – азотистое основание
ароматического характера. I. Как основание ·C5H5N+h3O —> [C5H5NH]OH гидроксид пиридина ·C5H5N+HCE —> [C5H5NH]CE хлорид пиридина II. Как ароматическое соединение: а) замещение C5H5N+h3SO4 —>[C5h5N]HSO3+h3O сульфопиридин C5H5N+HNO3 —>[C5h5N]NO2+h3O нитропиридин б) присоединение C5H5N+3h3 —>C5h21N пипиридин |
III. Итог урока.
Учитель сообщает основные выводы, полученные на данном занятии:
1. Гетероциклические соединения играют большую роль в функционировании живых организмов.
2. Строение вещества определяется не только качественным и количественным составом, но взаимным влиянием атомов.
3. Строение пиррола и пиридина определяет их химические свойства.
Поделиться страницей:xn--i1abbnckbmcl9fb.xn--p1ai
Карбоновые кислоты и их производные. Гетероциклические соединения, страница 11
Наиболее интересны гетероароматические соединения, свойства которых коренным образом отличаются от их углеводородных аналогов. Среди гетероароматических веществ наибольшее значение принадлежит пяти- и шестичленным гетероциклам, содержащих атомы азота, кислорода и серы.
Номенклатура гетероциклов очень сложна. Кроме того, в этом классе черзвычайно часто используют тривиальные названия, которые надо запомнить.
Можно отметить следующее:
· природу гетероатома указывают приставками окса-, тиа- и аза- для O, S и N гетероатомов соответственно;
· если в цикле несколько гетероатомов, их перечисляют в порядке старшинства S > O > N;
· нумерацию кольца всегда начинают со старшего гетероатома и выполняют так, чтобы сумма позиций гетероатомов была минимальна;
· пятичленные системы, имеющие в качестве гетероатома азот, называют азолами, шестичленные – азинами.

Пятичленные гетероароматические соединения с одним гетероатомом
Строение фурана, пиррола и тиофена
Обычные структурные формулы фурана, пиррола и тиофена указывают на гетеродиеновый характер этих соединений.
Однако эти гетероциклы в общем не обладают ожидаемыми свойствами. Например, пиррол не проявляет основных свойств, а тиофен не оксисляется, как это характерно для сульфидов.
Зато фуран, пиррол и тиофен вступают в реакции электрофильного замещения (нитрование, сульфирование, галогенирование, ацилирование по Фриделю-Крафтсу, реакцию Раймера-Тимана) характерные для ароматических систем.
Рассмотрим строение этих молекул.
Каждый атом цикла связан с соседними тремя s-связями, образованными за счет sp2-гибридных орбиталей, лежащих в одной плоскости. У атомов углерода остается по одному p-электрону, а у гетероатома – элетронная пара р-орбитали. Перекрывание четырех р-электронов углеродных атомов и пары р-электронов гетероатома приводит к возникновению тороидальных p-облаков над и под плоскостью цикла (см. рис. 42.1.). p-Электронные тороидальные облака содержат 6 p-электронов (как в бензоле).
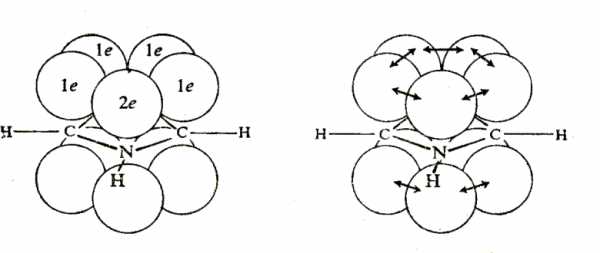 |
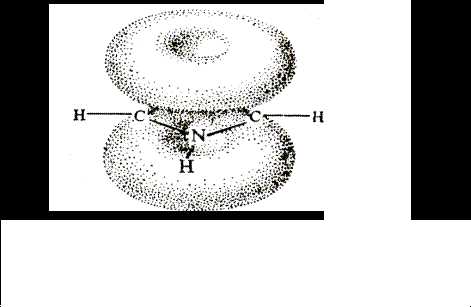
Рис. 42.1. Молекула пятичленного гетероароматического соединения
Делокализация стабилизирует молекулу. Она может быть показана также с помощью граничных структур.
Электроны гетероатома частично втянуты в гетероцикл, он позитивирован – молекулы обладают дипольным моментом.
Энергия делокализации пятичленных гетероароматических соединений находится в диапазоне 22-28 ккал/моль (самая низкая у фурана, самая высокая у тиофена). Такой выигрыш в энергии заметно меньше, чем у производных бензола (36 ккал/моль), но намного больше, чем у сопряженных диенов (около 3 ккал/моль). Различия в ароматичности пятичленных гетероциклов объясняются различной способностью гетероатомов удерживать около себя электроны. Чем сильнее атом удерживает электроны, тем меньше их делокализация и, следовательно, выигрыш в энергии.
Такое распределение электронной плотности приводит к важным результатам. Гетероатом пиррола не обладает основными свойствами – пара электронов сопряжена. NH-Группа пиррола проявляет слабокислые свойства. Говорят о пиррольном атоме азота – азоте проявляющие свойства аналогичные пирролу. В целом пиррольный атом азота по своим кислотно-основным свойствам больше всего напоминает амидный азот.
Получение фурана, пиррола и тиофена
Общий метод получения – циклизация g-дикарбонильных соединений. Обычно так получают 2,5-дизамещенные производные.

Незамещенный фуран обычно получают из фурфурола. Получение фурфурола основано на гидролизе полипентозанов – материалов богатых пентозами (отруби, кочерыжки кукурузы и т.п.). В результате гидролиза горячей кислотой образуются пентозы, которые далее циклизуются и дегидратируются.

Пиррол и тиофен содержатся в каменноугольной смоле, откуда их и добывают.
Пиррол может быть синтезирован циклизацией с одновременным аминированием ацетиленового спирта, получаемого по реакции Репе.
Синтетический тиофен получают реакцией элементарной серы с н-бутаном при высокой температуре.
В присутствии оксида алюминия при высокой температуре фуран, пиррол и тиофен способны превращаться друг в друга (так называемый «треугольник Юрьева»).

Лекция № 43
Гетероциклические соединения
Пятичленные гетероароматические соединения с одним гетероатомом
· Фуран. Реакция с малеиновым ангидридом. Ацидофобность. Реакции электрофильного замещения. p-Избыточность. Фурфурол, получение и свойства. Производные нитрофурана.
· Пиррол. Ацидофобность пиррола. Реакции электрофильного замещения по NН-группе. Пиррольный цикл как структурный элемент природных соединений. Порфин, образование хелатных комплексов. Понятие о порфиринах (гем, хлорофилл). Витамин В12.
· Тиофен. Реакции электрофильного замещения (сравнить с бензолом).
Химические свойства фурана, пиррола и тиофена
Фуран – самый неароматичный в ряду пятичленных гетероароматических соединений – проявляет свойства гетеродиена.
Он легко вступает в реакцию Дильса-Альдера с малеиновым ангидридом превращаясь в тетрациклический аддукт.
При пропускании смеси фурана с воздухом над оксидом ванадия (V) при 300о происходит окисление гетероцикла до малеинового ангидрида.
Несколько меньший диеновый характер проявляет пиррол. Он вступает в реакцию с малеиновым ангидридом, но образует продукт замещения, а не аддукт реакции Дильса-Альдера.
Диеновые свойства пиррол демонстрирует только в реакции восстановления водородом в момент выделения и при взаимодействии с трифенилметильным радикалом.

В нейтральной и основной средах фуран очень устойчив. В присутствии кислот происходит протонирование атома кислорода, которое приводит к разрыву в цепи сопряжения. В кислой среде фуран быстро полимеризуется с окислением, давая сложные смеси неразделяемых продуктов. Говорят, что фуран «ацидофобное» вещество.
vunivere.ru







